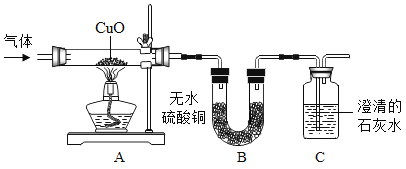
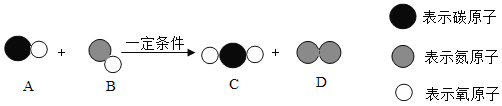��Ŀ����
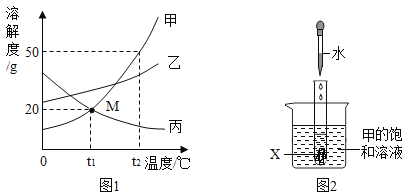
����Ŀ����ͼΪa��b��c�������ʣ��������ᾧˮ�����ܽ�����ߡ�
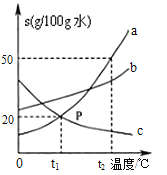
�� t2��ʱ��a��b��c�������ʵ��ܽ����С�����˳���� ��
�� t1��ʱ����80g��ˮ�м���20g c���ʣ���ֽ��裬������Һ�������� g��
�� ȡ������t2���� a��b��c �������ʵı�����Һ���ֱ���������ˮ��ָ���t2����a��b��c������Һ���������ʵ�����Ϊ ����a��b��c������=���� ����
����t1��ʱa��b��c�������ʵı�����Һ�����¶���t2����������Һ���������������Ĺ�ϵ�� ����a��b��c�� ����=���� ����
���𰸡���c��b��a��96g��a��b��c����c��b��a����b��a��c����c��a��b��
��������
�����������a��b��c�������ʵ��ܽ�����߿�֪����t2��ʱa�����ϵĵ���ߣ�b�����ϵĵ���Σ�c�����ϵĵ���ͣ�t1��ʱ��c���ʵ��ܽ��Ϊ20g,��100gˮ���ܽ�20gc���ʣ�����80gˮ���ܽ�c���ʵ�����Ϊ20g��100g��80g=16g��������Һ������Ϊ80g+16g=96g��������t2����ȡa��b��c������Һ��100g������t2��ʱ��a��b��c�������ʵ��ܽ�ȴ�СΪc��b��a������a��Һ�������������b��Һ��Σ�c��Һ��С��������ͬ��20gˮ����20gˮ��a�����ܽ����࣬b������Σ�c������С�����ڶ��DZ�����Һ��ˮ�����������ܽ������е���������������a��b��c������Һ�������ʵ�����Ϊa��b��c��t1��ʱ��a��b��c�������ʵ��ܽ��b��a=c����ʱb���ʵı�����Һ���������������a���ʺ�c���ʵı�����Һ������������һ�������ߵ�t2��ʱ������a���ʺ�b���ʵ��ܽ�����¶ȵ����߶���������û��������������Һ��Һ���������������䣬��c���ʵ��ܽ�����¶ȵ����߶���С��������c����������������Һ��Һ��������������С������a��b��c��������������Һ���������������Ĺ�ϵ��b��a��c��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�����Ŀ����ȥ���������е��������ʣ���ѡ�õ��Լ��Ͳ�������������ȷ���ǣ� ��
ѡ�� | ���� | ���� | �Լ����������� |
A | ϡ���� | ϡ���� | ������������������Һ������ |
B | �������� | �Ȼ��� | ����������ˮ���ܽ⡢���ˡ��������ᾧ |
C | ��������Һ | ���� | ��������������������Һ������ |
D | �Ȼ�����Һ | �������� | ��������ϡ������ |
A.AB.BC.CD.D