题目内容
【题目】2019年12月17日,我国首艘国产航母山东舰正式入列,中国海军正式迈入双航母时代。
(1)航母外壳用涂料覆盖,是为了防止钢铁材料与______________接触而锈蚀,而金属铝在空气中更耐腐蚀的原因是_________________(用化学方程式表示)
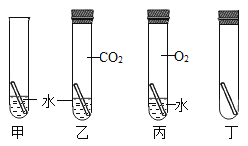
(2)为了探究航母材料中锌、铁、铜三种金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是_________________(填序号)。
A 稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉
B ZnCl2溶液中加入足量铁粉后,再加入CuCl2溶液
C ZnCl2溶液中加入足量铜粉后,再加入铁粉
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_____________________________(写化学式)。
【答案】氧气和水 ![]() AB ZnCl2和FeCl2
AB ZnCl2和FeCl2
【解析】
(1)航母外壳用涂料覆盖,是为了防止钢铁材料锈蚀,钢铁生锈的条件是与氧气和水接触;而金属铝在空气中极易与空气中的氧气反应生成一层致密的氧化铝薄膜包裹在铝制品表面,从而阻止反应进一步发生,起到保护内部铝的作用,所以更耐腐蚀,铝与氧气反应生成氧化铝的化学方程式为![]() 。故填:氧气和水;
。故填:氧气和水;![]() 。
。
(2)为了探究航母材料中锌、铁、铜三种金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是:
A. 稀盐酸中加入足量铁粉后,铁与盐酸反应生成氯化亚铁溶液,再加铜粉,铜不与氯化亚铁反应,从而证明铁的活动性比铜强,最后加入锌粉,锌又会将氯化亚铁中的铁置换出来,从而证明锌的活动性比铁强,所以该实验方案可以证明锌的活动性强于铁,铁强于铜。故A符合题意;
B. ZnCl2溶液中加入足量铁粉后,不能反应,从而得出锌的活动性强于铁,再加入CuCl2溶液,没反应的铁粉会置换出红色的铜,从而证明铁的活动性比铜强。故B符合题意;
C. ZnCl2溶液中加入足量铜粉后,铜不与氯化锌反应,从而证明锌的活动性强于铜,再加入铁粉,铁粉也不能与氯化锌反应,证明锌的活动性比铁强,所以无法证明铁铜的活动性强弱。故C不符合题意。
故选AB。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,铁可以分别与稀盐酸和氯化铜反应,生成氯化亚铁存在于溶液中,而氯化锌不参加反应,也存在与溶液中,故充分反应后过滤,滤液中含有的溶质是氯化锌和氯化亚铁。故填:ZnCl2和FeCl2。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】已知 KNO3的溶解度如下表所示,下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
A.在 10℃-70℃之间,随着温度的升高,KNO3的溶解度增大
B.20℃时,向 100 g 水中加入 35 g KNO3,充分搅拌,所得溶液质量为 131.6 g
C.将 70℃时不饱和的 KNO3溶液降低温度,有可能转化为饱和溶液
D.50℃时,饱和 KNO3溶液中溶质的质量分数为 85.5%