题目内容
【题目】某校九年级“我们爱化学”活动小组的同学,探究了过氧化钠(Na2O2)与二氧化硫(SO2)反应后所得固体产物的成分,过程如下: 【查阅资料】过氧化钠与二氧化硫反应的化学方程式为:2SO2+2Na2O2=2Na2SO3+O2 , 2Na2SO3+O2=2Na2SO4;SO2能使品红溶液褪色.
(1)【提出猜想】猜想1:固体成分为Na2SO3 猜想2:固体成分为Na2SO4
猜想3:
(2)【实验探究】用如图所示的装置进行实验.打开A中分液漏斗的活塞,反应发生(产生足量的SO2)后,用带火星的木条检验从a处导出的气体,木条复燃.实验前称得Na2O2固体的质量为78g,充分反应后称得生成物固体的质量为134g. 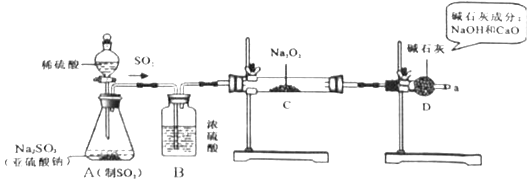
【实验结论】
(1 ) A是制取SO2气体的装置,反应的化学方程式与实验室制取CO2的化学方程式类似,请写出A中发生反应的化学方程式: .
(2 )由题中的实验现象,可推测猜想2是错误的.
(3 )装置B的作用是;装置D的作用是 .
(4 )根据反应前后固体的质量,可计算出Na2SO3的质量为g,Na2SO4的质量为g.
(3)【总结提升】 (1 )若实验前称得Na2O2固体的质量为m1g,充分反应后称得生成物固体质量为m2g,则m2的取值范围是(用含m1的关系式表示)
(2 )请另外设计一种实验方案,定性验证过氧化钠与二氧化硫反应后所得固体产物的成分:
【答案】
(1)Na2SO3和Na2SO4
(2)Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;用带火星的木条检验从a处导出的气体,木条复燃;干燥SO2;防止过量二氧化硫排放在环境中和防止空气中的二氧化碳和水蒸气进入C中;126;8
(3)![]() g<m2<
g<m2< ![]() m1g;将白色固体溶于水,滴加盐酸,收集气体,将气体通入品红溶液,若品红褪色,则说明含有Na2SO3;否则为硫酸钠.
m1g;将白色固体溶于水,滴加盐酸,收集气体,将气体通入品红溶液,若品红褪色,则说明含有Na2SO3;否则为硫酸钠.
【解析】解:【提出猜想】过氧化钠与二氧化硫反应的化学方程式为:2SO2+2Na2O2=2Na2SO3+O2 , 2Na2SO3+O2=2Na2SO4;猜想1:固体成分为Na2SO3 猜想2:固体成分为Na2SO4
猜想3:Na2SO3和Na2SO4;
【实验探究】(1)装置图分析可知装置A中是二氧化硫气体的发生装置,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;(2)打开A中分液漏斗的活塞,反应发生(产生足量的SO2)后,用带火星的木条检验从a处导出的气体,木条复燃,说明有氧气产生,而硫酸钠与硫酸不反应,故猜想2错误;(3)水能与过氧化钠反应,则浓硫酸可干燥气体,防止水参加反应,所以B中浓硫酸作用为干燥SO2;D中可防止过量二氧化硫排放在环境中和防止空气中的二氧化碳和水蒸气进入C中;(4)设生成Na2SO3的质量为x
2SO2+ | 2Na2O2= | 2Na2SO3+O2 |
156 | 252 | |
78g | x |
![]()
x=126g
Na2SO4的质量为134g﹣126g=8g;
【总结提升】(1)设充分反应后全部为Na2SO3+的质量为y,充分反应后全部为Na2SO4的质量为z
由2SO2+2Na2O2=2Na2SO3+O2 , 2Na2SO3+O2=2Na2SO4可知:
Na2O2~ | Na2SO3~ | Na2SO4 |
78 | 126 | 142 |
m1g | y | z |
![]()
y= ![]() g
g
z= ![]() m1g
m1g
则m2的取值范围是 ![]() g<m2<
g<m2< ![]() m1g
m1g
【总结提升】(1)(2)白色固体中含有Na2SO3 , 加盐酸后生成刺激性气体,利用品红褪色证明为二氧化硫,则检验方法为将白色固体溶于水,滴加盐酸,收集气体,将气体通入品红溶液,若品红褪色,则说明含有Na2SO3 , 否则为硫酸钠;
所以答案是:
【提出猜想】Na2SO3和Na2SO4;
【实验探究】(1)Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;(2)用带火星的木条检验从a处导出的气体,木条复燃;(3)干燥SO2;防止过量二氧化硫排放在环境中和防止空气中的二氧化碳和水蒸气进入C中;(4)126;8;
【总结提升】(1) ![]() g<m2<
g<m2< ![]() m1g;(2)将白色固体溶于水,滴加盐酸,收集气体,将气体通入品红溶液,若品红褪色,则说明含有Na2SO3;否则为硫酸钠.
m1g;(2)将白色固体溶于水,滴加盐酸,收集气体,将气体通入品红溶液,若品红褪色,则说明含有Na2SO3;否则为硫酸钠.
【考点精析】掌握书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道注意:a、配平 b、条件 c、箭号.

