题目内容
某学习小组用图示装置测定黄铜屑(铜锌合金)的组成,取一定量的黄铜屑放入烧杯中,并加入足量稀硫酸。不同时间电子天平的计数如下表所示(不考虑水分逸出):
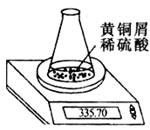
| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| 烧杯及所盛物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 |
| 反应时间/min | 5 | 6 | 7 | 8 | |
| 烧杯及所盛物质总质量/g | 335.32 | 335.31 | 335.30 | 335.30 |
(1)反应生成氢气的总质量是多少?
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是
(3)若该数据用a表示,求出黄铜屑中锌的质量分数
解:(1)根据质量守恒定律知氢气质量是:335.70-335.30=0.4g
(2)黄铜的质量
(3)设黄铜中锌的质量为![]()
![]()
65 2
![]() 0.4g
0.4g
![]() ,
,![]()
黄铜屑中锌的质量分数为:![]()
答:(略)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 锥形瓶及所盛物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是
(3)请你再设计一个测定黄铜屑中锌的质量分数的方案.
 测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 锥形瓶及所盛物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是________.若该数据用a表示,求黄铜屑中锌的质量分数(写出计算过程).
(3)请你再设计一个测定黄铜屑中锌的质量分数的方案.
 (2006?玄武区二模)测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
(2006?玄武区二模)测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):| 反应时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 锥形瓶及所盛物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.若该数据用a表示,求黄铜屑中锌的质量分数(写出计算过程).
(3)请你再设计一个测定黄铜屑中锌的质量分数的方案.