题目内容
【题目】实验室里测定空气中氧气的含量
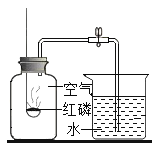
(1)红磷在空气中燃烧反应的表达式______________
(2)当红磷熄灭装置冷却到室温后,打开弹簧夹,看到的现象是_____________ 。
(3)实验测定结果偏低的原因可能是_________________;_______________(任写两种)
【答案】磷+氧气![]() 五氧化二磷 烧杯中的水进入集气瓶,且水约占集气瓶体积的1/5 红磷的量不足 装置漏气
五氧化二磷 烧杯中的水进入集气瓶,且水约占集气瓶体积的1/5 红磷的量不足 装置漏气
【解析】
(1)红磷在空气中燃烧生成五氧化二磷,反应的文字表达式为:磷+氧气![]() 五氧化二磷.
五氧化二磷.
(2)红磷在空气中燃烧消耗氧气,使瓶内压强减小,当红磷熄灭装置冷却到室温后,打开弹簧夹,看到的现象是烧杯中的水进入集气瓶,且水约占集气瓶体积的1/5.
(3)误差偏小的原因有:①红磷的量不足;②装置漏气;③没待装置冷却就打开了弹簧夹,并进行读数(因为此时剩余的气体在受热状态下,处于膨胀状态,占据了部分水的体积);④弹簧夹右边的导管中存有的空气进入集气瓶内;⑤红磷熄灭时,集气瓶中的氧气并没有完全耗尽,只是氧气的浓度达不到红磷燃烧的要求而已;⑥烧杯中的水可能不足以注满原来瓶内气体体积的1/5.
故答案为:(1)磷+氧气![]() 五氧化二磷;(2)烧杯中的水进入集气瓶,且水约占集气瓶体积的1/5;(3)红磷的量不足;装置漏气等.
五氧化二磷;(2)烧杯中的水进入集气瓶,且水约占集气瓶体积的1/5;(3)红磷的量不足;装置漏气等.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用。
实验装置如图所示(夹持仪器略)
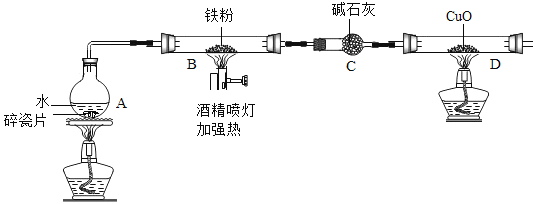
(1)(推断)观察到D中黑色固体变红,则B中生成的气体是_____________。
(2)探究B装置中剩余固体成分是什么?
(查阅资料)
(1).碎瓷片能防爆沸;碱石灰是氧化钙和氢氧化钠的混合物
(2).铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引。
(初步探究)
B装置中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)
猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是_____________。
(实验探究)
实验操作 | 实验现象及结论 |
取少量黑色固体于试管中,加入足量的稀盐酸(或稀硫酸) | 若固体全部溶解,没有气泡冒出,剩余固体是Fe3O4,若固体全部溶解,有气泡冒出,剩余固体是Fe和Fe3O4(与实验操作一致) |
(实验结论)铁与水蒸气反应的化学方程式为_____________。
(3)(成分再利用)若将B装置中剩余的黑色固体a g,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为_____________。
【题目】在一个密闭容器内有四种物质,在一定条件下完全反应后,测得反应前后各物质的质量如下:
物质 | X | Y | Z | Q |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量/g | 0 | 12 | 15 | 待测 |
已知X的相对分子质量为N,Q的相对分子质量为2N,下列推理正确的是( )
A. 反应后Q的质量为9 g
B. 反应中Y与Q发生改变的质量之比为1∶1
C. 反应后生成15 g Z
D. X与Q反应前的化学计量数之比为2∶1