题目内容
【题目】实验室常用下列装置来制取氧气:
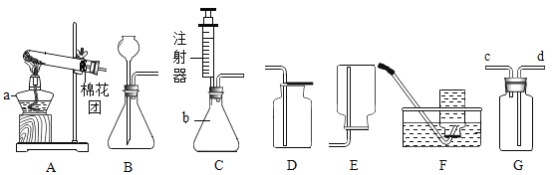
(1)写出图中有标号仪器的名称:a________;b________;
(2)B、C装置均可用来制取氧气。若用B装置来制取氧气,长颈漏斗添加药品的名称________;与B装置比较,C装置的优点是_______________,若用A装置在试管口放一团棉花,利用加热一种暗紫色固体制取氧气,其化学符号表达式为________________;
(3)可以用D装置收集氧气的原因是___________________,
(4)若用如图G装置收集较纯净氧气,可先在G装置中装满水,气体从________进入(填“c”或“d”);
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下氨气是一种无色有刺激性气味的气体,密度比空气小,极易溶于水。若制取并收集氨气,应该从上图A-E中选择的发生装置和收集装置分别是________、____________,
(6)以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | 过氧化氢溶液浓度%溶 | 过氧化氢溶液体积/mL | 温度/℃ | 二氧化锰的用量/g | 收集氧气的体积/mL | 反应所需的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
a.通过实验③和④对比可知,化学反应速率与温度的关系是_______________________;
b.若用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,则产生氧气的总重量将________选填“减小、不变或增大”)。
【答案】酒精灯 锥形瓶 过氧化氢(溶液) KMnO4 ![]() K2MnO4+MnO2+O2 可以控制反应的速率 氧气密度比空气大 d A E 温度越高反应速率越快 不变
K2MnO4+MnO2+O2 可以控制反应的速率 氧气密度比空气大 d A E 温度越高反应速率越快 不变
【解析】
(1)图中有标号仪器的名称:a是酒精灯;b是锥形瓶;
(2)B、C装置均可用来制取氧气。若用B装置来制取氧气,B装置是固、液混合不加热型,所用药品为过氧化氢溶液和二氧化锰,长颈漏斗添加药品的名称是过氧化氢溶液;C装置中注射器能控制液体滴加速率,从而能控制反应的速率,与B装置比较,C装置的优点是可以控制反应的速率,若用A装置在试管口放一团棉花,利用加热一种暗紫色固体制取氧气,高锰酸钾是暗紫色固体,用高锰酸钾制氧气时,为防止高锰酸钾进入导管,需在试管口放一团棉花,所以制取氧气药品是高锰酸钾,高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,其化学符号表达式为KMnO4 ![]() K2MnO4+MnO2+O2;
K2MnO4+MnO2+O2;
(3)用D装置收集氧气是向上排空气法收集,其原因是氧气密度比空气大;
(4)若用如图G装置收集较纯净氧气,可先在G装置中装满水,氧气的密度小于水,气体从d进入;
(5)根据“实验室常用氯化铵固体与碱石灰固体共热来制取氨气”可知,该反应的反应物是固体,反应条件是加热,根据“常温下氨气是一种无色有刺激性气味的气体,密度比空气小,极易溶于水”可知收集氨气只能用向下排空气法收集。若制取并收集氨气,应该从上图A-E中选择的发生装置和收集装置分别是A、E;
(6)a、实验③和④中,其他条件相同,只有温度不同,通过实验③和④对比可知,化学反应速率与温度的关系是温度越高反应速率越快;
b、若用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,加水稀释过程中,过氧化氢的质量不变,则产生氧气的总重量将不变。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案【题目】用化学符号表示:
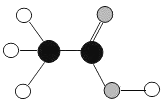
(1)将“分子”、“原子”、“元素”填入如图1序号所对应的横线上。
①_____;②____;③____。
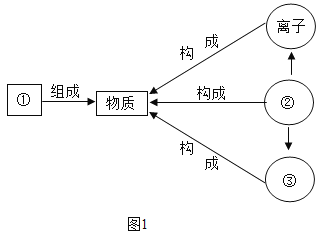
(2)在铜、氯化钠、二氧化碳三种物质中,由阴阳离子构成的是___。
(3)请用化学符号填写:
(1)二氧化硫 | (2)氧化钙中钙元素显+2价 | (3)2个氢原子 |
_____ | ____ | ____ |
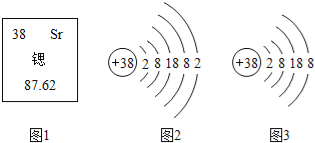
(4)根据原子结构的相关知识和图2的信息填空:
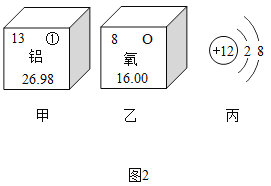
甲图中①代表的元素符号是___,乙图中所示元素原子的核电荷数是___,铝和氧两种元素形成化合物的化学式是____。丙图所示粒子属于____(填“原子”、“阳离子”或“阴离子”),其微粒符号是_____。