题目内容
【题目】有一包白色粉末,可能含有硫酸铜、氯化镁、氯化钡、硫酸钠中的一种或几种物质,实验小组设计如下实验方案,探究白色粉末的成分
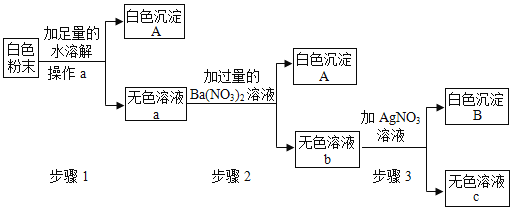
请回答:
(1)操作a的名称:_________,白色沉淀A的化学式为____________.
(2)由步骤1的现象判断,原白色粉末一定不含____________.
(3)无色溶液b中溶质的成分是___________________________.
(4)由以上实验可知,原白色粉末一定含有________________________.
(5)设计实验,验证白色粉末中可能含有的物质是否存在,请完成下表:
实验步骤 | 实验现象 | 实验结论 |
取少量c溶液于试管中,加入少量_______。 | ______________________。 | 可能含有的溶质存在 |
【答案】过滤 BaSO4 硫酸铜 氯化钠、硝酸钡、硝酸钠 氯化钡、硫酸钠 氢氧化钠溶液 白色沉淀
【解析】
硫酸铜在溶液中显蓝色,硫酸根离子和钡离子生成白色的硫酸钡沉淀,氯离子和银离子反应生成氯化银沉淀,所以白色粉末中加入足量的水溶解,得到白色沉淀A,无色溶液a,所以白色粉末中一定不含硫酸铜,一定含有氯化钡、硫酸钠,a中加入过量的硝酸钡生成白色沉淀A和无色溶液b,所以A是硫酸钡,b中含有反应剩余的硝酸钡,氯化钡和硫酸钠反应生成的氯化钠,硫酸钠和硝酸钡反应生成的硝酸钠,氯化钠和硝酸银反应生成氯化银沉淀。
(1)操作a是分离难溶性固体与液体的方法,是过滤操作,白色沉淀A的化学式BaSO4;
(2)由步骤1的现象判断,原白色粉末一定不含硫酸铜;
(3)无色溶液b中溶质的成分是:氯化钠、硝酸钡、硝酸钠;
(4)由以上实验可知,原白色粉末一定含有氯化钡、硫酸钠,可能含有氯化镁;
(5)检验氯化镁是否存在,即检验镁离子是否存在即可,检验时,取少量c溶液于试管中,加入少量氢氧化钠溶液,若产生白色沉淀,说明存在氯化镁,因为氯化镁和氢氧化钠反应生成氢氧化镁白色沉淀和氯化钠。

 阅读快车系列答案
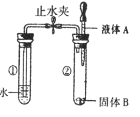
阅读快车系列答案【题目】因二氧化碳能溶于水,并能与水反应生成碳酸,所以二氧化碳一般不用排水法收集。二氧化碳气体究竟能否用排水法收集呢?某化学兴趣小组利用下图所示的两套装置进行了深入地探究。
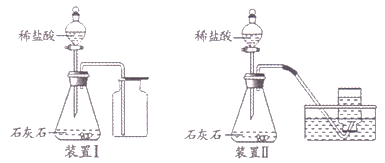
请写出石灰石与稀盐酸反应的化学方程式:______。
(定性实验)实验后,装置Ⅱ水槽中的液体应呈酸性,向此液体中滴加紫色石蕊试液溶液颜色会变为______。但是取几次实验后的液体样品,滴加紫色石蕊试液,均无明显变色现象。对此你认为可能的原因是______。
(定量实验)采用数字化实验测定排水法和向上排空气法收集的二氧化碳纯净度的差异。因实验设备有限,本实验通过氧气传感器测出收集气体中残留的氧气来自于空气),推算出空气的含量,再求出![]() 的含量。请填写下列表格中相应的空白(精确到1%即可):
的含量。请填写下列表格中相应的空白(精确到1%即可):
测得氧气含量 | 推算出 | 结论 | |
排空气法 | 6.6% | 69% | 排水法收集到的二氧化碳更纯净 |
排水法 | 4.2% | ______ |
通过实验可知,若对![]() 纯度要求较高,应该使用排水法收集二氧化碳。
纯度要求较高,应该使用排水法收集二氧化碳。
(实验反思)利用装置Ⅰ和装置Ⅱ收集到的二氧化碳都会混有少量空气,原因是______。
(交流讨论)证明排水法比排空气法所收集的二氧化碳气体纯度更高,还有什么方法?______。
(拓展应用)利用传感器对二氧化碳性质再探究。
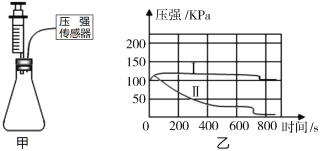
步骤1:如图1所示装置的气密性良好,三瓶![]() 的烧瓶内收集满
的烧瓶内收集满![]() 气体,三个注射器内各装有等体积的液体(分别是水、饱和石灰水、氢氧化钠浓溶液)。连接好装置和压强传感器。
气体,三个注射器内各装有等体积的液体(分别是水、饱和石灰水、氢氧化钠浓溶液)。连接好装置和压强传感器。
步骤2:三位同学同时迅速将注射器内等体积的液体(水、饱和石灰水、氢氧化钠浓溶液)注入各自烧瓶中,关闭活塞。
步骤3:一段时间后,同时振荡烧瓶。观察传感器定量实时地传回烧瓶内气压变化形成的图像情况如图2所示。
(查阅资料)氢氧化钙微溶于水,氢氧化钠易溶于水,均可与二氧化碳发生反应。

(1)导致曲线AB段气压增大的主要原因是:______。
(2)图中曲线1中______段气压的变化是由于充分振荡烧瓶导致的。
(3)利用现有的装置,在不使用其他试剂的情况下,请你写出除振荡烧瓶外继续降低E点的操作方法:______。
(4)曲线2与曲线3差异较大的原因是______。