题目内容
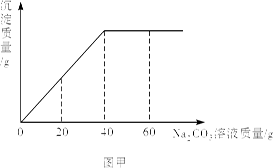
(10分)实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。请计算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体 g。
(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)

(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体 g。
(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
(1) 21.2g;(2)13.9%
根据质量分数公式求碳酸钠的质量;根据图象和化学方程式求氯化钡溶液的质量分数
(2)从图甲中获知,当BaCl2完全转化为沉淀时消耗Na2CO3溶液的质量为40g。
设BaCl2的质量为x,则 ------------------------------------(2分)
BaCl2+Na2CO3=BaCO3↓+2NaCl
208 106 ……………………(2分)
x 40g×26.5%
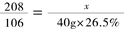
解得:x=20.8g
该BaCl2溶液的溶质质量分数=(20.8g/150g)x 100%="13.9%"
答:该BaCl2溶液的溶质质量分数为13.9%。
(2)从图甲中获知,当BaCl2完全转化为沉淀时消耗Na2CO3溶液的质量为40g。
设BaCl2的质量为x,则 ------------------------------------(2分)
BaCl2+Na2CO3=BaCO3↓+2NaCl
208 106 ……………………(2分)
x 40g×26.5%
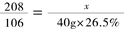
解得:x=20.8g
该BaCl2溶液的溶质质量分数=(20.8g/150g)x 100%="13.9%"
答:该BaCl2溶液的溶质质量分数为13.9%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

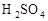
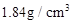 质量分数:98%
质量分数:98%