题目内容
【题目】实验室常用石灰石和稀盐酸制取二氧化碳。
探究一:气体发生装置的选择。
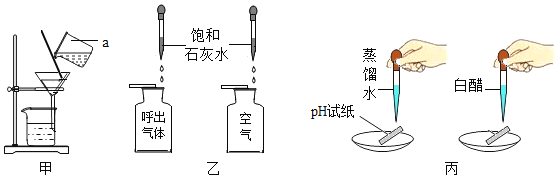
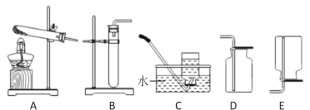
实验室制取二氧化碳气体,装置可选用______(填字母),检验集满的方法是_______
探究二:药品的选择。
小明对三组药品进行对比研究,实验记录如下:
组别 | 药品 | 实验现象 |
① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 粉末状石灰石和稀盐酸 | 产生气泡速率很快 |
对照实验①③,是探究_________对产生二氧化碳速率的影响;对照实验________,是探究不同的酸对产生二氧化碳速率的影响;小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为___________。
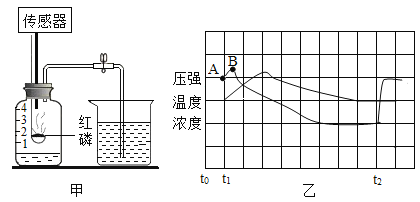
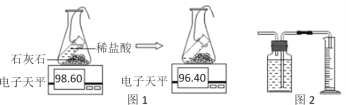
探究三:生成二氧化碳量的测定。途径一(如图1):由图可知产生二氧化碳的质量为_______g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。由上两种途径比较,你认为途径_______实验结果更为准确,理由是_________
【答案】BD 将燃着的木条放在集气瓶口,木条熄灭,证明集满 药品的状态 ①② CaCO3+2HCl=CaCl2+CO2↑+H2O 2.2 途径一 途径二中部分二氧化碳溶于水
【解析】
探究一:实验室制取二氧化碳气体无需加热,故发生装置可选用B,二氧化碳能溶于水且密度大于空气,故收集装置可用向上排空气法进行收集,装置选D,故装置选BD;检验集满的方法是将燃着的木条放在集气瓶口,木条熄灭,证明集满;
探究二:对照实验①③,石灰石状态不同,故该实验是探究药品的状态对产生二氧化碳速率的影响;对照实验①②,所用稀酸不同,故该实验是探究不同的酸对产生二氧化碳速率的影响;小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;
探究三:由图结合质量守恒定律可知,产生二氧化碳的质量为2.2g;二氧化碳能溶于水,故途径二中部分二氧化碳溶于水,导致体积不准确,故途经一更准确。

 阅读快车系列答案
阅读快车系列答案【题目】某同学为了测定NaCl和MgCl2固体混合物中MgCl2的质量分数,进行如下实验:将80g固体混合物溶于水配成溶液,平均分成四份,分别加入相同质量分数的NaOH溶液,获得如表实验数据:
实验次数 | 一 | 二 | 三 | 四 |
固体混合物的质量(g) | 20 | 20 | 20 | 20 |
加入NaOH溶液的质量(g) | 20 | 40 | 60 | 80 |
生成沉淀的质量(g) | 2.9 | m | 8.7 | 8.7 |
问:(1)表中m的值为_____;
(2)哪次实验恰好完全反应_____;求该次反应后所得溶液中氯化钠的质量共多少克_____?