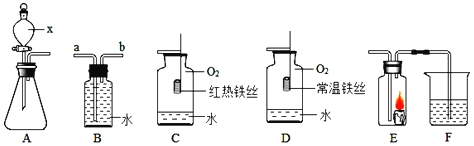
题目内容
【题目】某课外兴趣小组的同学绘制四种实验操作的变化趋势图像,其中正确的是
A.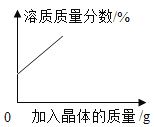 某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B. 向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液
向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液
C.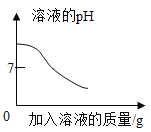 向稀盐酸中滴加过量的氢氧化钠溶液
向稀盐酸中滴加过量的氢氧化钠溶液
D.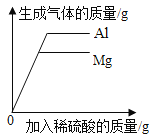 向等质量的金属镁和铝中分别加入足量且质量分数相等的稀硫酸
向等质量的金属镁和铝中分别加入足量且质量分数相等的稀硫酸
【答案】D
【解析】
试题根据具体变化时的物质的量的关系,结合图像分析判断。
A、向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体,硝酸钾会继续溶解,直至溶液达到饱和,故溶质质量分数会不断增大,但当溶液饱和时,溶液质量分数则不再改变,错误;
B、向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液,硫酸和硫酸铜均能与氢氧化钠溶液反应,且硫酸铜与氢氧化钠溶液反应生成的氢氧化铜沉淀会与溶液中的硫酸反应,又会生成硫酸铜,故相当于加入的氢氧化钠会先与硫酸反应,当硫酸完全反应后,才能与硫酸铜反应生成氢氧化铜沉淀,所以,开始时加入氢氧化钠,并没有沉淀生成,错误;
C、由于稀盐酸呈酸性,故pH<7,加入氢氧化钠后,二者发生中和反应,故pH增大,由于氢氧化钠过量,故最终所得溶液显碱性,故pH>7,错误;
D、当滴加的质量分数相等的稀硫酸的量不足时,酸会完全反应掉,由于氢气来自于酸,故相等量的酸完全反应所产生的氢气的量相等;当硫酸过量时,相同质量的镁和铝都会完全反应,而根据化学方程式的计算可知,等质量的镁、铝与足量的酸完全反应时,铝产生的氢气较多,正确。故选D

 小学生10分钟口算测试100分系列答案
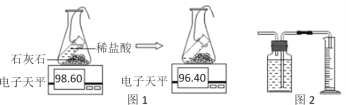
小学生10分钟口算测试100分系列答案【题目】实验室常用石灰石和稀盐酸制取二氧化碳。
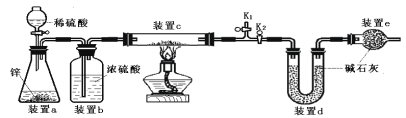
探究一:气体发生装置的选择。
实验室制取二氧化碳气体,装置可选用______(填字母),检验集满的方法是_______
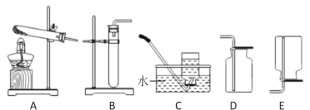
探究二:药品的选择。
小明对三组药品进行对比研究,实验记录如下:
组别 | 药品 | 实验现象 |
① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 粉末状石灰石和稀盐酸 | 产生气泡速率很快 |
对照实验①③,是探究_________对产生二氧化碳速率的影响;对照实验________,是探究不同的酸对产生二氧化碳速率的影响;小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为___________。
探究三:生成二氧化碳量的测定。途径一(如图1):由图可知产生二氧化碳的质量为_______g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。由上两种途径比较,你认为途径_______实验结果更为准确,理由是_________
【题目】为了探究中和反应,甲、乙两名同学分别向下列两支试管中滴加稀盐酸。
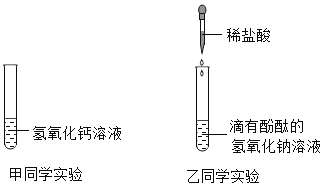
(1)乙同学向滴有酚酞的氢氧化钠溶液中逐渐加入稀盐酸,边滴加边振荡,乙同学意外发现有气泡产生,说明该氢氧化钠溶液已变质,变质的原因_________________________________ (用化学方程式表示).
(2)乙同学为了检验该氢氧化钠溶液的变质程度,设计实验方案并得出结论。
实验操作 | 实验现象 | 实验结论 |
取样少许于试管中,先滴加_________,再滴加_________ | ____________ | 氢氧化钠溶液部分变质 |
(3)实验结束后,甲、乙同学将他们两人试管中的废液倒入同一洁净烧杯中,得到无色澄清溶液,分析所得溶液中溶质的成分为①_______________,②_____________________(不考虑酚酞)。
(4)丙同学要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的_________.
A. 氢氧化钡溶液 B. 硝酸钡溶液 C. 氢氧化钙溶液 D. 氯化钠溶液。