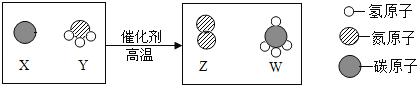
题目内容
【题目】推理是研究和学习化学的一种重要方法,下列推理正确的是( )
A.浓盐酸具有挥发性所以浓硫酸也具有挥发性
B.某固体中加入稀盐酸,生成无色无味的气体,证明该物质一定是碳酸盐
C.点燃氢气前需要检验纯度,所以点燃甲烷前也需要检验纯度
D.向碳酸钠溶液中滴加无色酚酞溶液,溶液变成红色,说明碳酸钠属于碱类
【答案】C
【解析】
试题分析:A、浓硫酸不具有挥发性;错误;B、碳酸盐和活泼的金属均能与稀盐酸反应释放出气体,故错误;C、可燃性气体不纯时遇明火会发生爆炸,所以点燃前需要验纯,故正确;D、碳酸钠是由金属阳离子和酸根阴离子构成的化合物,是一种盐,其水溶液显碱性,也能使无色酚酞试液变红色,故错误。故选C。

【题目】铁在生产生活中应用十分广泛.铁的冶炼和利用已成为目前科学研究和技术领域中的重要课题.
一、生活中使用的防寒热帖利用了铁生锈原理,其工作过程中实现了由化学能转化为 能.
二、铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭和氧气反应生成的一氧化碳把铁从铁矿石里还原出来,得到铁合金.一氧化碳还原氧化铁的化学方程式为 .
(1)甲同学为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
所取合金的质量∕g | 10 | 10 | 20 | 30 |
所加稀硫酸的质量∕g | 100 | 120 | 80 | X |
生成氢气的质量∕g | 0.3 | 0.3 | 0.3 | Y |
请回答:上表第四次实验中合金力的铁恰好与稀硫酸完全反应,则Y= g,该铁合金中铁的质量分数是多少(写出计算过程)?
(2)乙同学提出单质碳也具有还原性,碳还原氧化铁的化学方程式为 ,为什么工业上不用焦炭作为还原剂直接还原铁矿石?于是,他模拟工业炼铁设计如下对比实验(查阅资料获知NaOH溶液可吸收CO2气体);
①取两份相同质量的氧化铁粉末.一份与足量的碳粉均匀混合放入下图装置A的硬质试管总;另一份放入下图装置B的硬质玻璃管中.
②装置A和B两组实验同时开始进行.在装置B的反应中,实验开始前,先 (选填“通CO”或“加热”);实验结束后,继续通入CO直至冷却至室温.
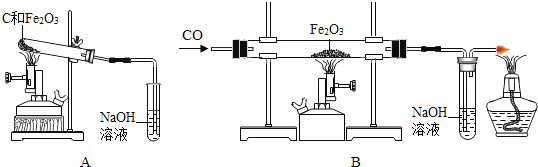
此时,发现装置B的硬质玻璃管中固体完全由 色变为 色,装置A的硬质试管中仍有红色固体.因而他认为焦炭和铁矿石都是固体,接触面积小,不易完全反应时工业上不用焦炭作为还原剂直接还原铁矿石的一个原因.
(3)丙同学经过查阅资料发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个 .
(4)丁同学利用图B装置,取不同质量的铁的氧化物进行实验.所得实验数据如下:
实验序号 | 铁的氧化物质量/g | 生成铁的质量/g |
1 | 4.00 | 2.81 |
2 | 8.00 | 7.62 |
3 | 10.00 | 7.01 |
4 | 12.00 | 8.42 |
5 | 14.00 | 9.81 |
6 | 16.00 | 11.22 |
7 | 18.00 | 12.63 |
8 | 20.00 | 14.03 |
从上表可以看出进行第2次实验时,所得数据十分不可靠,故舍去.请分析造成此种结果的原因主要可能是 .