题目内容
在一定质量的Fe中加入10倍其质量的稀硫酸刚好完全反应,则该稀硫酸的溶质质量分数为 .
【答案】分析:铁与稀硫酸反应,生成硫酸亚铁和氢气,反应所消耗硫酸的质量可利用反应的化学方程式,由铁的质量计算,进而计算出稀硫酸的溶质的质量分数;因此,通过假设铁的质量,反应消耗硫酸的质量和稀硫酸溶液的质量都可用铁的质量表示,可以据此解答.
解答:解:假设刚好完全反应时参加反应的铁的质量为m,则稀硫酸的质量为10m
设刚好完全反应时消耗硫酸的质量为x
Fe+H2SO4═FeSO4+H2↑
56 98
m x
 =
=
解得:x=
所以该稀硫酸的溶质的质量分数为: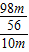 ×100%=17.5%
×100%=17.5%
故答案为:17.5%
点评:本题属于无数据计算类问题,在处理此类问题时,可以通过对数据的假设而解决,假设的数据最终应能相互约分而去掉.
解答:解:假设刚好完全反应时参加反应的铁的质量为m,则稀硫酸的质量为10m
设刚好完全反应时消耗硫酸的质量为x
Fe+H2SO4═FeSO4+H2↑
56 98
m x
 =
=
解得:x=

所以该稀硫酸的溶质的质量分数为:
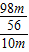 ×100%=17.5%
×100%=17.5%故答案为:17.5%
点评:本题属于无数据计算类问题,在处理此类问题时,可以通过对数据的假设而解决,假设的数据最终应能相互约分而去掉.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 (2013?盐城一模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
(2013?盐城一模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.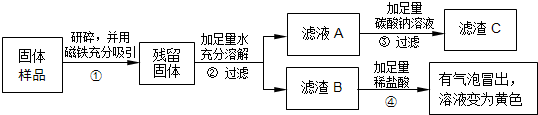
 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.