题目内容
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验方案,各步操作流程如下:

⑴在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是_________________。
⑵第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2 ___________(填化学式)。
⑶在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是____________。
⑷在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是____________。
⑸实验所得精盐的质量大于粗盐中的NaCl的质量,原因是_____________。
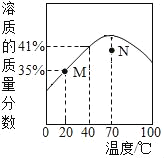
⑹某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如下图。

①纯碱恰好完全反应时,生成CO2的质量为___________g。
②计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是_____________。
【答案】 加速溶解 CaCO3 BaCO3 引入了新的杂质KCl 除去溶液中过量的氢氧化钠和碳酸钠 反应生成了氯化钠 4.4g 16.3%
【解析】本题考查了氯化钠与粗盐提纯,酸、碱、盐的化学性质,根据化学反应方程式的计算和有关溶质质量分数计算,综合性较强,认真审题,理清反应过程是解题的关键。
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是加快溶解速率;
(2)第②步中氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,第③步中氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,第④步中碳酸钠与过量的氯化钡反应生成碳酸钡沉淀和氯化钠,碳酸钠与氯化钙反应生成碳酸钙和氯化钠。第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、BaCO3;
(3)氢氧化钾会与氯化镁反应生成氢氧化镁沉淀和氯化钾,氯化钾对氯化钠来说就是杂质。在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是会带入新的杂质氯化钾;
(4)在第④、⑤步中加入过量的氢氧化钠和碳酸钠。在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去过量的氢氧化钠和碳酸钠;
(5)在第②③④步中均有氯化钠生成。在实验所得精盐的质量大于粗盐中NaCl的质量,原因是反应生成了氯化钠。
(6)根据加入稀盐酸的质量与放出气体质量的关系图,可知(1)纯碱恰好完全反应时,生成CO2的质量为4.4g,
(2)设:碳酸钠质量为x,生成氯化钠质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 117 44
x y 4.4g
![]() ,
, ![]()
x=10.6g,y=11.7g,
当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是: ![]() ×100%=16.3%,
×100%=16.3%,
答:当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是16.3%。

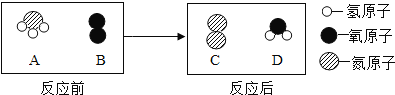
【题目】有一包粉末,可能由C、CuO、Fe三种物质中的一种或几种组成.某同学为了探究它的成分,按如下步骤进行实验.
(1)先对实验做了如下设想和取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况)。请你完成下表.
烧杯中可能出现的现象 | 结论 |
①有黑色不溶物,溶液呈无色 | 含______ |
②有黑色不溶物,溶液呈蓝色 | 含_________ |
③有黑色不溶物,有气泡逸出,溶液呈浅绿色 | 含_______ |
通过实验及分析,确定该粉末是C、CuO的混合物。
(2)为了进一步探究C、CuO的性质,他又利用这种混合物补充做了下面两个实验.
实验1:将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置.溶液呈_______色.
实验2:将此粉末隔绝空气加热(若碳完全反应),其化学反应方程式为 _______。待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。
①若静置后溶液呈无色,则该溶液中溶质是 ______(写化学式).
②若静置后溶液呈蓝色,该实验过程中所发生反应的化学方程式为______
【题目】下列实验均来自初中课本,对其中实验现象的描述错误的是( )
测定空气中氧气的含量 |
镁条在空气中燃烧 |
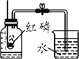
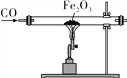
一氧化碳与氧化铁反应 |
用肥皂水区分软水和硬水 |
A. 集气瓶内的水面上升约至刻度“1”处 | B. 产生耀眼白光,生成白色固体 | C. 玻璃管内红色粉末变为黑色 | D. 软水中无泡沫,硬水中有大量泡沫 |
A. A B. B C. C D. D