题目内容
【题目】有一包粉末,可能由C、CuO、Fe三种物质中的一种或几种组成.某同学为了探究它的成分,按如下步骤进行实验.
(1)先对实验做了如下设想和取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况)。请你完成下表.
烧杯中可能出现的现象 | 结论 |
①有黑色不溶物,溶液呈无色 | 含______ |
②有黑色不溶物,溶液呈蓝色 | 含_________ |
③有黑色不溶物,有气泡逸出,溶液呈浅绿色 | 含_______ |
通过实验及分析,确定该粉末是C、CuO的混合物。
(2)为了进一步探究C、CuO的性质,他又利用这种混合物补充做了下面两个实验.
实验1:将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置.溶液呈_______色.
实验2:将此粉末隔绝空气加热(若碳完全反应),其化学反应方程式为 _______。待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。
①若静置后溶液呈无色,则该溶液中溶质是 ______(写化学式).
②若静置后溶液呈蓝色,该实验过程中所发生反应的化学方程式为______
【答案】碳(C) 碳、氧化铜(C、CuO) 碳、铁(C、Fe) 蓝 C+2CuO![]() 2Cu+CO2↑ H2SO4 CuO + H2SO4 = CuSO4+H2O
2Cu+CO2↑ H2SO4 CuO + H2SO4 = CuSO4+H2O
【解析】
(1)碳不与硫酸反应,铁与硫酸反应生成硫酸亚铁和氢气,现象为产生气泡,溶液由无色变成浅绿色,氧化铜和硫酸反应生成硫酸铜和水,溶液会变蓝。取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,①有黑色不溶物,固体质量不减少,且溶液仍为无色,只含碳;②有黑色不溶物,溶液由无色变为蓝色,说明含碳和氧化铜;③有黑色不溶物,有气泡逸出,溶液呈浅绿色,说明含碳和铁;
(2)实验1:将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置,溶液呈蓝色;
实验2:将此粉末隔绝空气加热(若碳完全反应),其化学反应方程式为C+2CuO![]() 2Cu+CO2↑。待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。
2Cu+CO2↑。待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。
①若静置后溶液呈无色,说明氧化铜完全反应,剩余固体为铜,铜与硫酸不反应,则该溶液中溶质是 H2SO4;.
②若静置后溶液呈蓝色,说明氧化铜有剩余,氧化铜和硫酸反应生成了硫酸铜和水,化学方程式为:CuO + H2SO4 = CuSO4+H2O。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
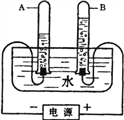
小学能力测试卷系列答案【题目】某化学小组将金属钠置于充满CO2的集气瓶中进行燃烧,反应后集气瓶内有黑色固体和白色固体生成.于是他们进行了如下探究:
(1)依据镁和二氧化碳反应的原理推测,钠和二氧化碳反应生成的产物是_____.
在老师指导下查阅资料可知:
①钠不仅可以在二氧化碳中燃烧,而且在常温下就可以与空气中的氧气、水等物质反应.
②氧化钠与氧化钙相似,也可以和水发生反应.
③碳酸钠溶液显碱性,氯化钙溶液显中性.
(2)实验验证:
实验步骤 | 实验现象 | 实验结论 | |
实验1 | 取少量白色固体于试管中,加入足量水振荡,滴加2滴无色酚酞 | 白色固体完全溶解,且溶液呈红色 | 白色固体是氧化钠 |
实验2 | 取少量白色固体于试管中,加入适量稀盐酸 | 白色固体完全溶解,且有气体产生 | 白色固体是碳酸钠 |
实验3 | 取少量实验1的溶液,加入适量的氢氧化钙溶液,静置后,滴加2滴无色酚酞 | 有白色沉淀产生,溶液呈红色 | 白色固体是氧化钠和碳酸钠 |
实验4 | 取少量实验1的溶液,加入过量的氯化钙溶液,静置后,滴加2滴无色酚酞 | 有白色沉淀产生,溶液呈无色 | 白色固体是碳酸钠 |
①上述实验_____(填实验序号)结论正确.
②钠在CO2中燃烧的化学方程式为_____.
(3)实验反思
①若钠着火,可以选用的灭火物质是_____.
A 水 B 泡沫灭火剂 C 干沙土 D 二氧化碳
②对上述不正确结论的解释是_____.