题目内容
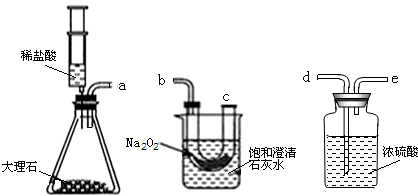
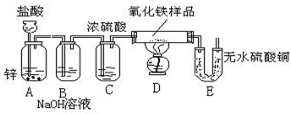 利用如图所示的实验装置,测定某氧化铁样品中氧化铁的质量分数.回答下列问题:
利用如图所示的实验装置,测定某氧化铁样品中氧化铁的质量分数.回答下列问题:
(1)如果采用稀硫酸代替盐酸,你认为能否省略B装置?(填“能”或“不能”)________.
(2)D中的现象是________.
(3)假设样品中杂质不反应,且B、C、E装置吸收是完全的.若样品为10g,完全反应后D装置质量减少了2.4g,E装置质量增加了2.9g,请分析计算样品中氧化铁的质量分数最好用________装置的数据进行计算,理由是________,若你选用的数据正确,则样品中氧化铁的质量分数为________.
(4)如果将装置C去掉,那么测定出的结果,比实际样品中氧化铁的质量分数(填“偏大”或“偏小”或则“不影响”)________.
解:(1)稀硫酸不具有挥发性,因此如果采用稀硫酸代替盐酸,能省略B装置;
故答案为:能;
(2)氢气还原氧化铁生成铁和水,因此D中现象是物质由红色变成黑色;
故答案为:物质由红色变成黑色;
(3)因E中的无水硫酸铜会吸收空气中的水分,所以应选D装置中的数据进行计算;
D装置质量减少了2.4g,减少的是氧化铁中氧元素的质量,因此Fe2O3的质量为2.4g÷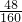 =8g,则样品中Fe2O3的质量分数为
=8g,则样品中Fe2O3的质量分数为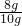 ×100%=80%,
×100%=80%,
故答案为:D;E中的无水硫酸铜会吸收空气中的水分,导致水的质量增大;80%;
(4)如果没有C装置,即没有吸收氢气中的水分,我们是按照D装置中数据进行计算,有没有吸收水分对测定结果没有影响,故答案为:不影响.
分析:(1)根据稀硫酸的性质分析;
(2)根据实验中的现象进行分析;
(3)D装置质量减少了2.4g,减少的是氧化铁中氧元素的质量,进而求得Fe2O3的质量及质量分数.
(4)我们是按照D装置中数据进行计算,有没有吸收水分对测定结果没有影响.
点评:该题通过一氧化碳还原氧化铁的实验考查样品中氧化铁的质量分数、操作步骤及误差分析,属于综合探究题.
故答案为:能;
(2)氢气还原氧化铁生成铁和水,因此D中现象是物质由红色变成黑色;
故答案为:物质由红色变成黑色;
(3)因E中的无水硫酸铜会吸收空气中的水分,所以应选D装置中的数据进行计算;
D装置质量减少了2.4g,减少的是氧化铁中氧元素的质量,因此Fe2O3的质量为2.4g÷
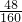 =8g,则样品中Fe2O3的质量分数为
=8g,则样品中Fe2O3的质量分数为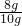 ×100%=80%,
×100%=80%,故答案为:D;E中的无水硫酸铜会吸收空气中的水分,导致水的质量增大;80%;
(4)如果没有C装置,即没有吸收氢气中的水分,我们是按照D装置中数据进行计算,有没有吸收水分对测定结果没有影响,故答案为:不影响.
分析:(1)根据稀硫酸的性质分析;
(2)根据实验中的现象进行分析;
(3)D装置质量减少了2.4g,减少的是氧化铁中氧元素的质量,进而求得Fe2O3的质量及质量分数.
(4)我们是按照D装置中数据进行计算,有没有吸收水分对测定结果没有影响.
点评:该题通过一氧化碳还原氧化铁的实验考查样品中氧化铁的质量分数、操作步骤及误差分析,属于综合探究题.

练习册系列答案
相关题目
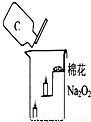
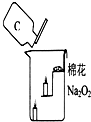 过氧化钠是一种黄色固体,化学式为Na2O2,化学兴趣小组的同学将包有过氧化钠固体的棉花放入如图所示的烧杯中,缓慢倒入二氧化碳气体后,发现位于下面的蜡烛先熄灭,上面的后熄灭,同时发现棉花燃烧起来.
过氧化钠是一种黄色固体,化学式为Na2O2,化学兴趣小组的同学将包有过氧化钠固体的棉花放入如图所示的烧杯中,缓慢倒入二氧化碳气体后,发现位于下面的蜡烛先熄灭,上面的后熄灭,同时发现棉花燃烧起来.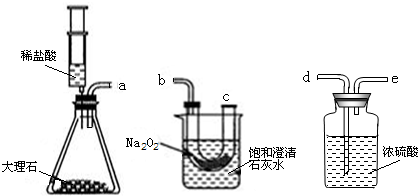
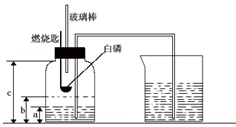 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下: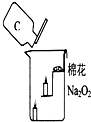 过氧化钠是一种黄色固体,化学式为Na2O2,化学兴趣小组的同学将包有过氧化钠固体的棉花放入如图所示的烧杯中,缓慢倒入二氧化碳气体后,发现位于下面的蜡烛先熄灭,上面的后熄灭,同时发现棉花燃烧起来.
过氧化钠是一种黄色固体,化学式为Na2O2,化学兴趣小组的同学将包有过氧化钠固体的棉花放入如图所示的烧杯中,缓慢倒入二氧化碳气体后,发现位于下面的蜡烛先熄灭,上面的后熄灭,同时发现棉花燃烧起来.