��Ŀ����
 ����������һ�ֻ�ɫ���壬��ѧʽΪNa2O2����ѧ��ȤС���ͬѧ�����й������ƹ������������ͼ��ʾ���ձ��У��������������̼�������λ�������������Ϩ������ĺ�Ϩ��ͬʱ������ȼ��������
����������һ�ֻ�ɫ���壬��ѧʽΪNa2O2����ѧ��ȤС���ͬѧ�����й������ƹ������������ͼ��ʾ���ձ��У��������������̼�������λ�������������Ϩ������ĺ�Ϩ��ͬʱ������ȼ����������1��ʵ���У�λ�������������Ϩ������ĺ�Ϩ����һ����˵��������̼����
��2����Ϊʲô��ȼ���أ�С��ͬѧ����������ȼ�յ����֪ʶ����������Ҫȼ�գ��������㡰���ǿ�ȼ���һ����������Ҫ�����������
������⣺��ʵ��������θ���ȼ���ṩ�����������أ�
�������ϣ��ڳ�����Na2O2��CO2�ܷ�����ѧ��Ӧ��
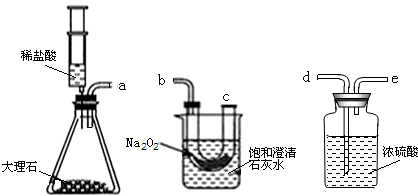
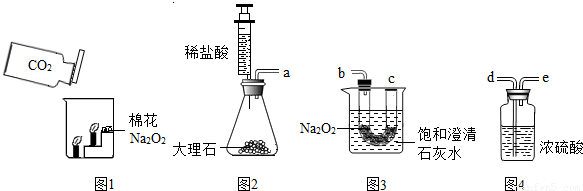
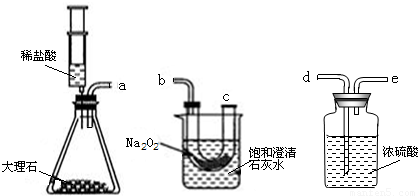
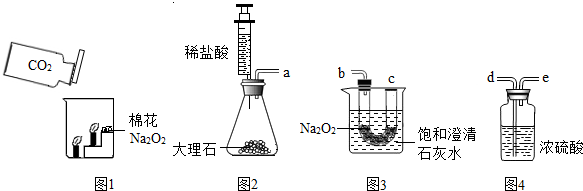
���ʵ�飺�������ۺ�С��ͬѧ������ͼ��ʾ��ʵ��װ�ý���̽����ҪʹNa2O2��CO2��Ӧ��ʵ��װ���е��ܿ���ȷ������˳����
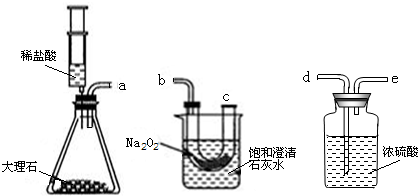
ʵ�鲽�裺�ٰ�����˳��װ��װ�ã�������������ԣ�����ҩƷ��
���ƶ�ע����������ϡ����ע����ƿ�У�
��һ��ʱ�����β��������һ�������ǵ�Сľ�����۲�����
ʵ���������ǵ�Сľ����ȼ�ұ��ͳ���ʯ��ˮ����ǣ�
ʵ���������Ũ�����������
���ձ��ڱ���ǵ�ԭ����
ʵ����ۣ��١�Сľ����ȼ��˵����Na2O2��CO2��Ӧ������
�ڡ����͵ij���ʯ��ˮ����ǡ�˵��Na2O2��CO2��Ӧ
��3����֪Na2O2��CO2��Ӧ�������������ͬʱ���д������ɣ���ʵ�������U�ܵ�����������1.2g��������������������
������������̼�����ܶȱȿ������ҼȲ�ȼ��Ҳ��֧��ȼ�յ����ʣ�������������ȼ�յ��������п�ȼ��������Ӵ����¶ȴﵽ��ȼ����Ż�㣬ҪʹNa2O2��CO2��Ӧ�����ȥ�����Ķ�����̼�е�ˮ�������Է���ɸ��ţ�Ũ���������ˮ�ԣ���������������������������������̼��Ӧ�ų�������ʹ�¶����ߣ��������Ƶ��ܽ�����¶ȵ����߶���С���������������ƹ����ʹ��Һ����ǣ������������������̼��Ӧ����̼���ƺ�����������U��ֱ���Ǹ������ӿ������������������
����⣺
��1��λ�������������Ϩ������ĺ�Ϩ��˵�������ܶȱȿ������ҼȲ�ȼ��Ҳ��֧��ȼ�յ����ʣ����Ա����Ϊ��������̼�ܶȴ��ڿ����ܶȣ���ȼ��Ҳ��֧��ȼ�գ�
��2��ȼ�յ��������п�ȼ��������Ӵ����¶ȴﵽ��ȼ����Ż�㣬���Ա����Ϊ���������¶ȡ��ﵽ�����Ż�㣻
ҪʹNa2O2��CO2��Ӧ�����ȥ�����Ķ�����̼�е�ˮ�������Է���ɸ��ţ�ʹ��Ũ������������̼����ʱ����ʹ����ӳ��ܽ������ƿ���Ӷ̹��ݳ������Ա����Ϊ��adeb��
Ũ���������ˮ�ԣ�������������������ڳ�ˮ�����Ա����Ϊ����ȥCO2�е�ˮ������
�����������������̼��Ӧ�ų�������ʹ�¶����ߣ��������Ƶ��ܽ�����¶ȵ����߶���С���������������ƹ����ʹ��Һ����ǣ����Ա����Ϊ���¶����ߣ��������Ƶ��ܽ�ȼ�С������������
��Сľ����ȼ��˵����Na2O2��CO2��Ӧ���������������Ա����Ϊ��������
�����͵ij���ʯ��ˮ����ǡ�˵��Na2O2��CO2��Ӧ�ų���������ע��˴�ǿ�����DZ�����Һ�Ļ��ǣ�Ӧ�ÿ��������������ʵ��ܽ��Ա仯���ƣ������Ա����Ϊ���ų���
��3������������������Ϊx������
2Na2O2+2CO2�T2Na2CO3+O2����m
156 212 32 56
x 1.2g
=
x��0.7g
��1��λ�������������Ϩ������ĺ�Ϩ��˵�������ܶȱȿ������ҼȲ�ȼ��Ҳ��֧��ȼ�յ����ʣ����Ա����Ϊ��������̼�ܶȴ��ڿ����ܶȣ���ȼ��Ҳ��֧��ȼ�գ�
��2��ȼ�յ��������п�ȼ��������Ӵ����¶ȴﵽ��ȼ����Ż�㣬���Ա����Ϊ���������¶ȡ��ﵽ�����Ż�㣻
ҪʹNa2O2��CO2��Ӧ�����ȥ�����Ķ�����̼�е�ˮ�������Է���ɸ��ţ�ʹ��Ũ������������̼����ʱ����ʹ����ӳ��ܽ������ƿ���Ӷ̹��ݳ������Ա����Ϊ��adeb��
Ũ���������ˮ�ԣ�������������������ڳ�ˮ�����Ա����Ϊ����ȥCO2�е�ˮ������
�����������������̼��Ӧ�ų�������ʹ�¶����ߣ��������Ƶ��ܽ�����¶ȵ����߶���С���������������ƹ����ʹ��Һ����ǣ����Ա����Ϊ���¶����ߣ��������Ƶ��ܽ�ȼ�С������������
��Сľ����ȼ��˵����Na2O2��CO2��Ӧ���������������Ա����Ϊ��������
�����͵ij���ʯ��ˮ����ǡ�˵��Na2O2��CO2��Ӧ�ų���������ע��˴�ǿ�����DZ�����Һ�Ļ��ǣ�Ӧ�ÿ��������������ʵ��ܽ��Ա仯���ƣ������Ա����Ϊ���ų���
��3������������������Ϊx������
2Na2O2+2CO2�T2Na2CO3+O2����m
156 212 32 56
x 1.2g
| 32 |
| x |
| 56 |
| 1.2g |
x��0.7g
����������̽���˹��������������̼��Ӧ���й�֪ʶ����ɴ��⣬��Ҫ����������г�ȡ���õ���Ϣ��Ȼ����н��⣮

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
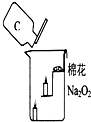 ����������һ�ֻ�ɫ���壬��ѧʽΪNa2O2����ѧ��ȤС���ͬѧ�����й������ƹ������������ͼ��ʾ���ձ��У��������������̼�������λ�������������Ϩ������ĺ�Ϩ��ͬʱ������ȼ��������
����������һ�ֻ�ɫ���壬��ѧʽΪNa2O2����ѧ��ȤС���ͬѧ�����й������ƹ������������ͼ��ʾ���ձ��У��������������̼�������λ�������������Ϩ������ĺ�Ϩ��ͬʱ������ȼ��������