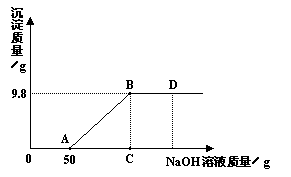
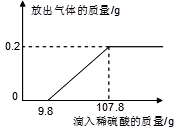
题目内容
将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
A.表中a的值为2.6 B. X一定是该反应的催化剂
C. X可能含有氢元素 D.若起始时氧气的质量是9.6g,则无X生成
| 物质 | 乙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 4.6 | 8.0 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 5.4 | 4.4 | a |
C. X可能含有氢元素 D.若起始时氧气的质量是9.6g,则无X生成
D
由表中数据分析可知,反应前后,乙醇的质量减少了4.6g,故乙醇是反应物,参加反应的乙醇的质量为4.6g;同理可以确定氧气是反应物,参加反应的氧气的质量为8.0g;水是生成物,生成的水的质量为5.4g;生成二氧化碳的质量为4.4g;由质量守恒定律,X应是生成物,且生成的X的质量为4.6g+8.0g﹣5.4g﹣4.4g=2.8g,故表中a的值为为0g+2.8g=2.8g;故A选项说法错误;由A选项分析可知,X的质量增加,故一定不是该反应的催化剂,故B选项说法错误;根据反应前后元素质量不变,反应物乙醇中含氢元素的质量为4.6g×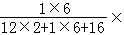 100%=0.6g,生成物水中含氢元素的质量为5.4g×
100%=0.6g,生成物水中含氢元素的质量为5.4g×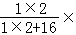 100%=0.6g,氢元素的质量相等,故X中不含氢元素;故C选项说法错误;根据乙醇燃烧的方程式可知,4.6克乙醇能与9.6克的氧气恰好完全反应,生成了二氧化碳和水;故D选项说法正确。
100%=0.6g,氢元素的质量相等,故X中不含氢元素;故C选项说法错误;根据乙醇燃烧的方程式可知,4.6克乙醇能与9.6克的氧气恰好完全反应,生成了二氧化碳和水;故D选项说法正确。
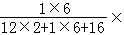 100%=0.6g,生成物水中含氢元素的质量为5.4g×
100%=0.6g,生成物水中含氢元素的质量为5.4g×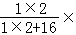 100%=0.6g,氢元素的质量相等,故X中不含氢元素;故C选项说法错误;根据乙醇燃烧的方程式可知,4.6克乙醇能与9.6克的氧气恰好完全反应,生成了二氧化碳和水;故D选项说法正确。
100%=0.6g,氢元素的质量相等,故X中不含氢元素;故C选项说法错误;根据乙醇燃烧的方程式可知,4.6克乙醇能与9.6克的氧气恰好完全反应,生成了二氧化碳和水;故D选项说法正确。
练习册系列答案
相关题目
 Na2CO3 + H2O + CO2↑ ,碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g。求:样品中碳酸钠的质量分数。
Na2CO3 + H2O + CO2↑ ,碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g。求:样品中碳酸钠的质量分数。