题目内容
 (2013?宝坻区二模)(1)某同学在实验室做中和反应实验,用胶头滴管吸取10%的稀盐酸逐滴加入到盛有氢氧化钠溶液的烧杯中.
(2013?宝坻区二模)(1)某同学在实验室做中和反应实验,用胶头滴管吸取10%的稀盐酸逐滴加入到盛有氢氧化钠溶液的烧杯中.①实验中,要用玻璃棒不断搅拌,这样做的目的是使反应充分快速;
②实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是
防止所加盐酸溶液过量
防止所加盐酸溶液过量
;③实验中发现有气泡出现,你认为原因可能是
氢氧化钠溶液变质生成了碳酸钠
氢氧化钠溶液变质生成了碳酸钠
;④实验后,向所得溶液中滴入几滴无色酚酞溶液,溶液颜色没有变化,这能否说明反应恰好完全达到终点?理由是
如果盐酸过量,加入酚酞溶液,溶液也不变色
如果盐酸过量,加入酚酞溶液,溶液也不变色
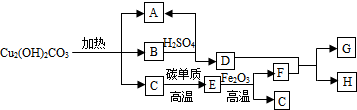
(2)“孔雀石”的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是一种重要的铜矿石原料,受热可以分解为三种常见的化合物,与其它物质转化关系如图,其中A是最常见的液态物质,B为黑色固体,C为常见气体,F、G为金属单质.
根据图示推断并回答下列问题:
①B的化学式为
CuO
CuO
;②写出D+F→G+H的化学反应方程式
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
;③向Cu2(OH)2CO3加入足量稀盐酸,固体完全溶解,生成三种物质,其中有无色气体生成,写出此反应的化学方程式
4HCl+Cu2(OH)2CO3=2CuCl2+CO2↑+3H2O
4HCl+Cu2(OH)2CO3=2CuCl2+CO2↑+3H2O
.分析:(1)②根据胶头滴管滴加液体比较精确考虑;③根据氢氧化钠变质生成碳酸钠考虑;④根据酸性溶液和中性溶液都不能使酚酞试液变色;(2)“孔雀石”的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是一种重要的铜矿石原料,受热可分解为三种常见的化合物,物质转化关系如图,其中A是最常见的液态物质,则A为水,B是黑色固体(可能是氧化铜),F、G为金属单质.
解答:解:(1)②由于该实验的一个方面是探究两种溶液是否恰好完全反应,用胶头滴管滴加是为了防止所加溶液过量;
③氢氧化钠易与空气中的二氧化碳反应,生成碳酸钠和水,碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,有气泡产生;
④酸性溶液和中性溶液都不能使酚酞试液变色,如果盐酸过量,加入酚酞溶液,溶液也不变色,所以不能说无色酚酞试液不变色就是恰好完全反应;
(2)①根据质量守恒定律可知反应前后元素种类不变,B为黑色固体,因为氧化铜是黑色固体,且碱式碳酸铜中含有铜元素和氧元素,所以B是氧化铜,化学式是CuO;
②“孔雀石”的主要成分是碱式碳酸铜[Cu2(OH)2CO3],受热分解为三种常见的化合物,根据质量守恒定律可知反应前后元素种类不变,其中A是最常见的液态物质,则A为水,B是黑色固体是氧化铜,C为常见气体所以C是二氧化碳,碳与二氧化碳反应生成一氧化碳,所以E是一氧化碳,一氧化碳与氧化铁反应生成铁和二氧化碳,F是铁,由于B是氧化铜,与硫酸反应生成硫酸铜,所以D是硫酸铜,所以D和F反应是铁与硫酸铜反应生成铜和硫酸亚铁;所以方程式是:Fe+CuSO4=FeSO4+Cu;
③向Cu2(OH)2CO3]中加入足量的盐酸,固体完全溶解,有无色气体生成,生成了氯化铜、水和二氧化碳,二氧化碳后面标上上升符号,用观察法配平,所以方程式是:4HCl+Cu2(OH)2CO3=2CuCl2+CO2↑+3H2O.
故答案为:(1)②防止所加盐酸溶液过量;③氢氧化钠溶液变质生成了碳酸钠;④如果盐酸过量,加入酚酞溶液,溶液也不变色;(2)①CuO;②Fe+CuSO4=FeSO4+Cu;③4HCl+Cu2(OH)2CO3=2CuCl2+CO2↑+3H2O.
③氢氧化钠易与空气中的二氧化碳反应,生成碳酸钠和水,碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,有气泡产生;
④酸性溶液和中性溶液都不能使酚酞试液变色,如果盐酸过量,加入酚酞溶液,溶液也不变色,所以不能说无色酚酞试液不变色就是恰好完全反应;
(2)①根据质量守恒定律可知反应前后元素种类不变,B为黑色固体,因为氧化铜是黑色固体,且碱式碳酸铜中含有铜元素和氧元素,所以B是氧化铜,化学式是CuO;
②“孔雀石”的主要成分是碱式碳酸铜[Cu2(OH)2CO3],受热分解为三种常见的化合物,根据质量守恒定律可知反应前后元素种类不变,其中A是最常见的液态物质,则A为水,B是黑色固体是氧化铜,C为常见气体所以C是二氧化碳,碳与二氧化碳反应生成一氧化碳,所以E是一氧化碳,一氧化碳与氧化铁反应生成铁和二氧化碳,F是铁,由于B是氧化铜,与硫酸反应生成硫酸铜,所以D是硫酸铜,所以D和F反应是铁与硫酸铜反应生成铜和硫酸亚铁;所以方程式是:Fe+CuSO4=FeSO4+Cu;
③向Cu2(OH)2CO3]中加入足量的盐酸,固体完全溶解,有无色气体生成,生成了氯化铜、水和二氧化碳,二氧化碳后面标上上升符号,用观察法配平,所以方程式是:4HCl+Cu2(OH)2CO3=2CuCl2+CO2↑+3H2O.
故答案为:(1)②防止所加盐酸溶液过量;③氢氧化钠溶液变质生成了碳酸钠;④如果盐酸过量,加入酚酞溶液,溶液也不变色;(2)①CuO;②Fe+CuSO4=FeSO4+Cu;③4HCl+Cu2(OH)2CO3=2CuCl2+CO2↑+3H2O.
点评:物质推断要在明显的结论的协助下,逐一突破,注意相互的限制制约的利用.

练习册系列答案
相关题目