题目内容
4.有一包白色粉末可能含有CaCO3、Na2CO3、Na2SO4、CuSO4、NaNO3中的一种或几种,某学生为了确定其组成,做如下实验,请根据实验现象进行推断,(1)在试管中加入少量粉末,注入足量的蒸馏水充分震荡溶液无色透明;
(2)取少量上述溶液滴入氯化钡溶液,有白色沉淀产生;
(3)滴加足量稀硝酸,沉淀部分溶解并且有气泡产生.该白色粉末中一定含有Na2CO3;(填化学式,下同)一定没有CaCO3、CuSO4;
(4)写出过程中的化学方程式Na2CO3+BaCl2=2NaCl+BaCO3↓;BaCl2+Na2SO4=2NaCl+BaSO4↓;
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑.
分析 根据碳酸钙难溶于水,CuSO4在溶液中显蓝色,碳酸钠和稀硝酸反应会生成二氧化碳,碳酸钠和氯化钡会生成能溶于硝酸的白色碳酸钡沉淀,硫酸钠和氯化钡会生成不溶于硝酸的硫酸钡沉淀等知识进行分析.
解答 解:碳酸钙难溶于水,CuSO4在溶液中显蓝色,碳酸钠和稀硝酸反应会生成二氧化碳,碳酸钠和氯化钡会生成能溶于硝酸的白色碳酸钡沉淀,硫酸钠和氯化钡会生成不溶于硝酸的硫酸钡沉淀.
在试管中加入少量粉末,注入足量的蒸馏水充分振荡溶液无色透明,碳酸钙难溶于水,CuSO4在溶液中显蓝色,所以白色粉末中一定不含碳酸钙和CuSO4,(2)取少量上述溶液滴入氯化钡溶液,有白色沉淀产生,则一定有Na2SO4,在(3)中滴加稀硝酸沉淀全部溶解,并有气泡产生,所以白色粉末中含有碳酸钠,白色粉末中是否含有硝酸钠,不影响题中的实验现象,所以白色粉末中一定含有:Na2CO3;一定没有CaCO3、Na2SO4、CuSO4;可能含有NaNO3.
故答案为:
(3)Na2CO3; CaCO3、CuSO4;
(4)Na2CO3+BaCl2=2NaCl+BaCO3↓;BaCl2+Na2SO4=2NaCl+BaSO4↓;
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑.
点评 在解此类题时,首先分析所给混合物中各物质的性质,然后根据题中所给的实验现象进行判断,最后确定混合物的组成成分.

练习册系列答案
相关题目
4.下列图象反映所对应叙述关系正确的是( )
| A. | 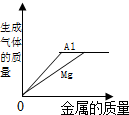 等质量等质量分数的稀硫酸中分别加入镁和铝 | |
| B. | 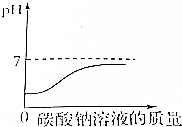 稀盐酸中不断滴入碳酸钠溶液 | |
| C. | 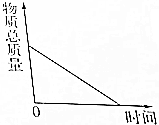 一定质量的木炭与过量氧气在密闭容器中加热充分反应 | |
| D. | 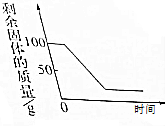 煅烧一定质量的石灰石 |
9.右图是某化工厂生产的产品包装袋上的标签.
(1)计算碳酸氢铵中各元素的原子个数比.
(2)计算碳酸氢铵的相对分子质量
(3)某农民李大伯需向自己的责任田中追施氮元素8.4kg;需这种氮肥多少千克?
(4)通过计算判断此产品是否是合格产品?
| 碳酸氢铵 化学式:NH4HCO3 含氮量:16.8% 纯度:95% 净重:50 kg |
(2)计算碳酸氢铵的相对分子质量
(3)某农民李大伯需向自己的责任田中追施氮元素8.4kg;需这种氮肥多少千克?
(4)通过计算判断此产品是否是合格产品?
13.如图表示两种物质发生的化学反应,其中相同的球代表同种原子,小球间的短线代表原子间的结合.下列说法中不正确的是( )
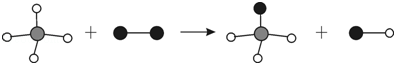

| A. | 图示有4种分子 | B. | 图示反应前后原子个数不变 | ||
| C. | 图示发生了置换反应 | D. | 图示产物为混合物 |
14.研究和学习化学,有许多方法.下列方法中所举例错误的是( )
| 选项 | 方法 | 示例 |
| A | 实验法 | 用浓氨水、酚酞溶液做“分子运动现象”实验 |
| B | 分类法 | 根据原子的最外层电子数,将元素分为金属元素、非金属元素、稀有气体元素 |
| C | 归纳法 | 根据木炭、硫等物质能在氧气中燃烧,归纳出氧气具有助燃性 |
| D | 类比法 | 根据镁带能在空气中燃烧,推测铁丝也能在空气中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
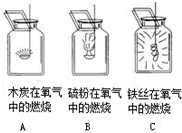 某同学测试各种物质在纯净的氧气中燃烧的实验如图所示.
某同学测试各种物质在纯净的氧气中燃烧的实验如图所示.