题目内容
【题目】(5分)一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验:
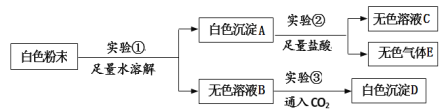
(1)由实验①可知原白色粉末中一定不含有 。
(2)由实验②可知原白色粉末中一定含有 。
(3)白色沉淀D为 ,写出实验③的总反应的化学方程式 。
(4)根据整个实验还可推断原白色粉末中一定不含 。
【答案】(1)CuSO4
(2)CaCO3
(3)BaCO3 BaCl2+2NaOH+CO2=BaCO3↓+2NaCl+H2O
(4)Na2SO4
【解析】
试题分析:于硫酸铜溶于水变为蓝色溶液,而经过实验①得到无色溶液,故(1)由实验①可知原白色粉末中一定不含有硫酸铜;
(2)由实验②知道沉淀全部溶解与稀盐酸,说明沉淀不是硫酸钡,而是碳酸钙,可知原白色粉末中一定含有碳酸钙;无色溶液B中通入二氧化碳产生白色沉淀,故溶液B 中含有钡离子,
(3)白色沉淀D为碳酸钡,实验③的总反应的化学方程式BaCl2+2NaOH+CO2=BaCO3↓+2NaCl+H2O;
(4)根据整个实验还可推断原白色粉末中一定不含硫酸钠。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案【题目】如图所示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如箭头所指方向的转化.下列符合上述要求的一组物质是

甲 | 乙 | 丙 | X | Y | Z | |
A | HCl | NaOH | Na2CO3 | Cu | CuO | CuSO4 |
B | HCl | Ba(OH)2 | Na2CO3 | H2O2 | H2O | O2 |
C | H2SO4 | NaOH | K2CO3 | C | CO | CO2 |
D | H2SO4 | Ba(OH)2 | K2CO3 | CaO | Ca(OH)2 | CaCO3 |
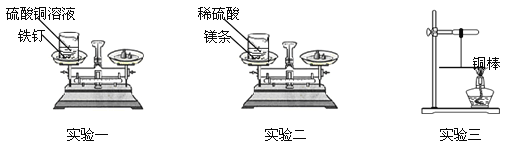
【题目】(5分)某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
【设计并实验】
实验一:将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量。然后将铁钉浸到硫酸铜溶液中,观察现象。待反应一段时间后溶液颜色改变时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验二:将盛有稀硫酸的烧杯和镁条一起放在托盘天平上称量,然后将镁条浸到稀硫酸中,观察现象。待反应一段时间后不再放出气泡时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验一和实验二的数据见下表:
编 号 | 实验一 | 实验二 |
反应前/g | 118.4 | 112.6 |
反应后/g | 118.4 | 112.4 |
实验三:用细线系住铜棒中点使之平衡,然后在铜棒一端用酒精灯加热。加热一段时间后,观察到铜棒的平衡情况是 。
【分析与讨论】
(1)在这三个实验中,你认为:实验 正确反映了反应物与生成物之间的质量关系,由此得出的结论是:在化学反应中生成物的总质量与反应物的总质量相等,请从原子的角度分析结论正确的理由是 。
(2)另外两个实验得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,你认为导致这一结论错误的原因是 (只写其中一个实验的原因即可)。
【实验反思】小组成员从不能正确反映反应物和生成物之间质量关系的两个实验中,找出了实验设计中的不当之处,并达成了以下共识:设计实验验证质量守恒定律时,对于有空气中的气体(成分)参与或有气体生成的化学反应,一般应使反应在 中进行。