题目内容
【题目】化学反应“H2SO4+2NaOH═Na2SO4+2H2O”的基本类型属于____;铁制容器不能承装CuSO4溶液的原因用化学方程式解释为___;一定质量的KClO3与agMnO2混合加热至完全反应,生成氧气的质量为bg,剩余固体的质量为cg,则反应后生成KCl的质量为___g.
【答案】复分解反应 Fe+CuSO4=FeSO4+Cu ![]()
【解析】
(1)由“H2SO4+2NaOH=Na2SO4+2H2O”反应的方程式可知,反应是两种化合物通过相互交换成分得到两种化合物的反应,属于复分解反应;
(2)铁的活动性比铜强,因此可以把铜从其盐溶液中置换出来,从而降低药效,反应的方程式为:Fe+CuSO4=FeSO4+Cu;
(3)因为无法判断一定质量的KClO3是否完全反应,所以agMnO2和剩余固体的质量为cg,固体可能是二氧化锰、氯化钾、氯酸钾三种物质,不能用来计算氯酸钾的质量。则利用氧气的质量,根据化学方程式进行计算;
设反应后生成KCl的质量为x,
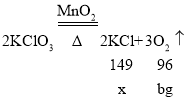
![]()
x=![]()

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
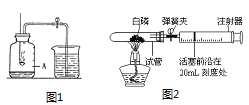
普通高中同步练习册系列答案【题目】在高温下,铁与水蒸气能发生反应生成一种常见铁的氧化物和一种气体,某化学 学习小组的同学对此反应甩感兴趣,在小组集体协作下设计了如下实验,以探究铁粉与水蒸气反应后的产物,也邀请你一起来完成下列探究:
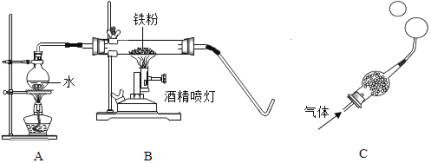
(1)A装置的作用是___;
(2)探究生成的气体是什么?
(猜想与假设)猜想一:生成的气体可能是氢气;
猜想二:生成的气体可能是氧气;
(实验探究)将生成的气体通入C装置,球形管里装有碱石灰干燥剂,导管口蘸些肥皂水(或洗涤剂溶液),控制气体流速,吹出肥皂泡,当肥皂泡吹到一定大时,轻轻摆动导管,肥皂泡脱离管口后,气泡上升.用燃着的木条靠近肥皂泡,有爆鸣声.
(推断)生成的气体是___.
(3)探究试管中剩余固体成分是什么?
(查阅资料)
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被进磁铁吸引 | 否 | 否 | 能 |
能否与盐酸反应 | 能 | 能 | 能 |
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引.
(猜想与假设)猜想一:剩余固体是Fe和Fe3O4;
猜想二:剩余固体是:___.
(实验探究)
实验操作 | 实验现象及结论 |
____ | _____ |
[实检结论]铁与水蒸气反应的化学方程式为:___.
(反思与交流)该黑色固体不可能是FeO、Fe2O3,理由是___.