题目内容
小王同学在厨房中发现一袋白色粉末状的食用物,包装袋上表示的化学成分字迹不清,于是他带到实验室探究其成分。(填空没空1分,计算4分,计10分)
【猜想与假设】猜想1.可能是淀粉 猜想2.可能是纯碱
猜想3.可能是食盐 猜想4.可能是 (俗称小苏打)
【查阅资料】小苏打溶液显碱性,与氯化钡溶液不反应
【实验探究】
小华认为,实验(3)结论不准确,原因是 。小华进一步进行了如下实验:取28g 所配溶液与50.2g氯化钡溶液混合,两种物质恰好完全反应。立即出现 ,由此他知道了该白色粉末是何物。过滤,所得滤液质量为58.5g,试计算:
(4)反应后生成的沉淀质量为 克.
(5)所得滤液中溶质的质量分数为多少?
【猜想与假设】猜想1.可能是淀粉 猜想2.可能是纯碱
猜想3.可能是食盐 猜想4.可能是 (俗称小苏打)
【查阅资料】小苏打溶液显碱性,与氯化钡溶液不反应
【实验探究】
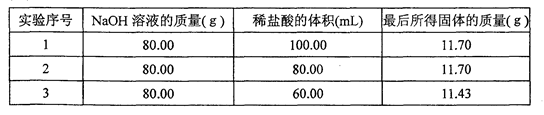
| 实验操作 | 实验现象 | 实验结论 |
| (1)取样,溶于适量的水 | 形成无色溶液 | 猜想 不成立 |
| (2)取少量品尝 | 有苦涩味 | 不是 |
| (3)向(1)的溶液中滴加酚酞试液 | 溶液变红 | 是纯碱 |
(4)反应后生成的沉淀质量为 克.
(5)所得滤液中溶质的质量分数为多少?
NaHCO3 ;;(1) 1;(2)食盐;(3)小苏打溶液显碱性也能使酚酞变红、白色沉淀;(3)19.7;(4)20%
试题分析:根据物质的俗名可知猜想为碳酸氢钠,【实验探究】(1)取样,溶于适量的水形成无色溶液,猜想1不成立;(2)取少量品尝,有苦涩味,说明不是食盐;(3)向(1)的溶液中滴加酚酞试液,溶液变红,说明是纯碱的说法是不正确的叙述,因为小苏打溶液显碱性也能使酚酞变红,根据题中提供的资料,取28g 所配溶液与50.2g氯化钡溶液混合,两种物质恰好完全反应。立即出现白色沉淀,由此他知道了该白色粉末是碳酸钠,(4)根据质量守恒定律知,反应后生成沉淀的质量为:28g+50.2g-58.5g=19.7g;
(5)设反应生成氯化钠为X
Na2CO3+BaCl2==BaCO3↓+2NaCl
117
19.7g X
197:117=19.7g:X
X=11.7g
所得滤液中溶质的质量分数为:
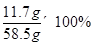 =20%
=20%
练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑