题目内容
取12.5g石灰石样品(杂质不与酸反应且不含钙元素)放入烧杯中,向烧杯中逐滴加入稀盐酸至不产生气泡为止,共生成二氧化碳4.4g.求:
(1)该石灰石样品中碳酸钙的质量?
(2)该石灰石样品中钙元素的质量分数?
(1)该石灰石样品中碳酸钙的质量?
(2)该石灰石样品中钙元素的质量分数?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据二氧化碳的质量可以计算碳酸钙的质量;
(2)根据碳酸钙的质量可以计算钙元素的质量,从而求出石灰石样品中钙元素的质量分数.
(2)根据碳酸钙的质量可以计算钙元素的质量,从而求出石灰石样品中钙元素的质量分数.
解答:解:
(1)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
=
x=10g
(2)10g碳酸钙中钙元素的质量为:10g×
×100%=4g
该石灰石样品中钙元素的质量分数:
×100%=32%
答案:
(1)该石灰石样品中碳酸钙的质量10g
(2)该石灰石样品中钙元素的质量分数32%
(1)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
x=10g
(2)10g碳酸钙中钙元素的质量为:10g×
| 40 |
| 40+12+16×3 |
该石灰石样品中钙元素的质量分数:
| 4g |
| 12.5g |
答案:
(1)该石灰石样品中碳酸钙的质量10g
(2)该石灰石样品中钙元素的质量分数32%
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,比较简单,计算时要注意规范性和准确性.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
将80℃的硝酸钾饱和溶液降温到20℃时,对原溶液来说,①溶液的质量;②溶质的质量;③溶液中溶质的质量分数;④溶质的溶解度;⑤溶剂的质量.以上各项中,没有发生变化的是( )
| A、①②④⑤ | B、②⑤ |
| C、②④⑤ | D、只有⑤ |
可用同一化学原理解释的现象是( )
①久置的石灰水,液面上出现一层薄膜;
②用吸管向澄清石灰水中吹气,石灰水变浑浊;
③为了使石灰浆刷过的墙壁快点干燥,在室内生一盆炭火,开始时墙壁反而潮湿;
④向紫色石蕊溶液中通入二氧化碳气体,溶液变红;
⑤检验二氧化碳气体.
①久置的石灰水,液面上出现一层薄膜;
②用吸管向澄清石灰水中吹气,石灰水变浑浊;
③为了使石灰浆刷过的墙壁快点干燥,在室内生一盆炭火,开始时墙壁反而潮湿;
④向紫色石蕊溶液中通入二氧化碳气体,溶液变红;
⑤检验二氧化碳气体.
| A、①②③④ | B、①②③⑤ |
| C、①②④⑤ | D、①③④⑤ |
2013年“世界水日”的主题是“水与粮食安全”.下列说法错误的是( )
| A、将生活用水,地表雨水分类处理,可减少污染,保护水资源 |
| B、农业生产中改变灌溉方式,变漫灌为喷灌或滴灌,以节约用水 |
| C、为了避免水体污染,农业上应合理使用农药和化肥 |
| D、水的天然循环能实现水的重新分配,不需要兴建水利工程 |
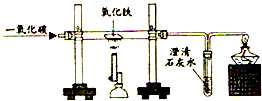 某小组同学用如图所示的原理来炼铁.请回答下列问题.
某小组同学用如图所示的原理来炼铁.请回答下列问题. 帕拉米韦注射液可用于治疗H7N9禽流感,其说明书中部分内容如图.
帕拉米韦注射液可用于治疗H7N9禽流感,其说明书中部分内容如图.