题目内容
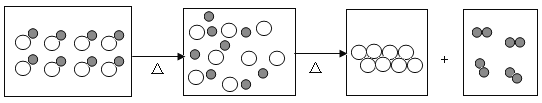
【题目】如图所示是探究二氧化锰在过氧化氢分解中做催化剂的过程:
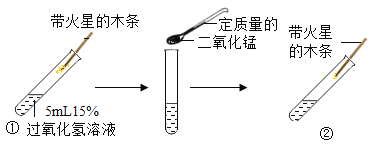
(1)实验①中看到的现象是带火星的木条不复燃,说明_____。
(2)实验②中看到的现象是有气泡产生,带火星的本条复燃,说明_____。
(3)待实验②中试管内无气泡冒出时,再加入过氧化氢溶液。发现又有气泡产生,在此实验基础上,设计实验进一步证明反应后二氧化锰质量没有变化_____。
【答案】常温下过氧化氢分解的非常缓慢,生成氧气少 加入二氧化锰可以使过氧化氢加速分解生成氧气,生成氧气多 在加入二氧化锰前先称量其质量为m1,再取试验后的浊液进行过滤、洗涤固体、干燥、称量,直至固体质量不在改变,质量为m2,对比发现m1= m2;
【解析】
(1)实验①中木条不复燃,说明氧气浓度不足以支持木条复燃,即常温下过氧化氢分解的非常缓慢,生成氧气少;
(2)再加入二氧化锰后木条复燃了,说明过氧化氢分解产生了氧气,提高了氧气浓度,故验证了加入二氧化锰可以使过氧化氢加速分解生成氧气,氧气较多;
(3)要验证二氧化锰质量的变化,则应在加入二氧化锰前先称量其质量为m1,再取试验后的浊液进行过滤、洗涤固体、干燥、称量,直至固体质量不在改变,质量为m2,通过对比
m1和m2得到二氧化锰质量是否改变;。
故答案为:常温下过氧化氢分解的非常缓慢;加入二氧化锰可以是过氧化氢加速分解生成氧气;在加入二氧化锰前先称量其质量为m1,再取试验后的浊液进行过滤、洗涤固体、干燥、称量,直至固体质量不在改变,质量为m2,对比发现m1= m2。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目