题目内容
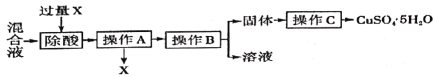
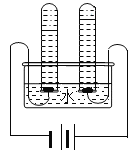
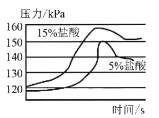
【题目】(1)某同学设计了如图1所示的实验装置探究影响锌和盐酸反应速率的因素。
① 该装置气密性的检查方法是__________________________
② 如图所示实验中的实验现象是__________________________。

③用压强传感器替换注射器进行实验,测得等质量且过量的锌片分别与等质量、浓度为5%、15%的稀盐酸反应时压强随时间的变化关系曲线如上图所示。根据该图中的信息,你能得出的两条合理结论是:_____________;_______________;
(2)为了证明过氧化钠(Na2O2)固体可在呼吸面具和潜水艇中做供氧剂,某化学兴趣 小组的同学利用下图所示的实验装置进行探究活动。
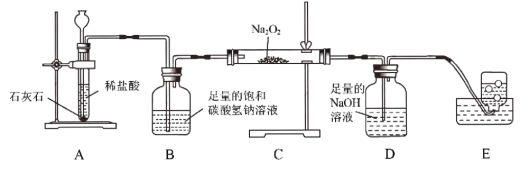
己知:2Na2O2+2CO2=2Na2CO3+ O2,2Na2O2+2H2O =4NaOH+O2↑
①用E装置收集气体时,判断气体收集满的方法是: __________________ ;
②D装置的作用是 _____________________ ;
③实验结束后,取出C装置中的固体溶于水,有气泡产生,得到无色溶液。则该无色溶液中存在的溶质是 ________________ (填化学式)。
④与高锰酸钾制氧气的方法相比,过氧化钠(Na2O2)固体作为呼吸面具和潜水艇中的供氧剂的主要优点是: _______________ (任答一点)。
【答案】关闭分液漏斗的活塞,然后用手向右拉注射器的活塞,松开手后,若活塞能恢复到原来的刻度,说明装置的气密性是良好的 锥形瓶内产生气泡,注射器的活塞向右移动 在其他条件相同时,盐酸的浓度越大,产生的氢气越多 在其他条件相同时,盐酸的浓度越大,反应的速率越快 集气瓶口有大气泡向外冒出,说明氧气已满 除去氧气中混有的二氧化碳 Na2CO3、NaOH 反应在常温下进行(操作简单或反应消耗了人体呼出的二氧化碳气体)
【解析】
(1)①该装置气密性的检查方法是关闭分液漏斗的活塞,形成密封体系,然后用手向右拉注射器的活塞,松开手后,若活塞能恢复到原来的刻度,说明装置的气密性是良好的;故填:关闭分液漏斗的活塞,然后用手向右推注射器的活塞,松开手后,若活塞能恢复到原来的刻度,说明装置的气密性是良好的;
②锌和盐酸反应生成氢气,锥形瓶内产生气泡,造成装置内的压强增大,观察到注射器的活塞向右移动;故填:锥形瓶内产生气泡,注射器的活塞向右移动;
③由图象信息可知,在其他条件相同时,盐酸的浓度越大,产生的氢气越多;在其他条件相同时,盐酸的浓度越大,反应的速率越快;
(2)①用排水法来收集氧气时,当观察到集气瓶口有大气泡向外冒出时,说明氧气已经收集满;故填:集气瓶口有大气泡向外冒出,说明氧气已满;
②在装置C中的过氧化钠与二氧化碳反应生成氧气和碳酸钠,可能部分二氧化碳没有完全反应,所以氢氧化钠溶液的作用是除去氧气中混有的二氧化碳;故填:除去氧气中混有的二氧化碳;
③实验结束后,取出C装置中的固体溶于水,有气泡产生,说明C中还有未完全反应的过氧化钠,过氧化钠与水反应生成氢氧化钠,所以得到的无色溶液中含有氢氧化钠、碳酸钠;故填:Na2CO3、NaOH;
④与加热高锰酸钾制氧气方法相比,过氧化钠作为呼吸面具和潜水艇的供氧剂,装置简单,原料易得,反应能在常温下进行,反应消耗了人体呼出的二氧化碳气体;故填:反应在常温下进行(操作简单或反应消耗了人体呼出的二氧化碳气体)。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】氯化钠、碳酸钠、硝酸钾在不同温度时的溶解度如下表所示,某同学根据表中数据作出了其中一种物质的溶解度曲线(如下图所示),请根据表和图中信息填空。
| 0 | 10 | 20 | 30 | 40 |
氯化钠 | 35.7 | 35.8 | 36 | 36.5 | 37 |
碳酸钠 | 6 | 16 | 18 | 36.5 | 50 |
硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |

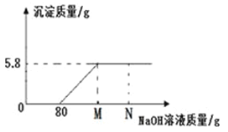
(1)曲线M是表中_____的溶解度曲线,该物质在5℃时的溶解度约为___g。
(2)如果将表中三种物质的溶解度曲线全部画出,在0℃~40°C范围内会有_____个两线交点。
(3)10℃时,将15g氯化钠和15g硝酸钾固体同时加入盛有50g水的烧杯中,充分搅拌、溶解、静置后,烧杯底部剩余的固体是_________。
【题目】化学实验探究总是能引起同学们的兴趣。某化学兴趣小组在实验室实验时发现了一瓶标签缺损的溶液,如下图。为了确认其溶质成分,同学们进行了如下探究:
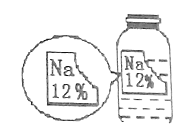
(提出猜想)猜想一:NaCl; 猜想二:Na2CO3;猜想三: NaHCO3 猜想四:NaOH
(设计实验一)
小明取少量溶液样品于试管中,用玻璃棒蘸取溶液滴在pH试纸上,读取数据,pH=9,得出结论,猜想四成立。
小王认为小明的结论不准确,理由是:________________。
从小明的实验结果中可以判断出猜想_________也一定是错误的。
(设计实验二)小红取适量稀盐酸于试管中,滴加少量此溶液,溶液中产生气泡。于是认为猜想二正确。
小王认为仍然不能确定,理由是_______________。
(查阅资料)常温下,碳酸钠和碳酸氢钠的溶解度为以下表格中的数据。
Na2CO3 | NaHCO3 | |
溶解度/g | 21.8 | 9.6 |
(分析结论)从资料显示的数据,再结合药品的标签,可以判断猜想_________不正确,理由是_____________________。
(问题交流)(1)Na2CO3和 NaHCO3在生活中被称为“苏打兄弟”,其中NaHCO3在生活中可用来_______________ (写出一条即可)。
(2)Na2CO3在空气中长期放置,会吸收空气中水蒸气和另一种气体而转变成 NaHCO3。请你写出反应方程式________________________。
[注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。]
兴趣小组和老师一起继续实验,将盐酸滴加到Na2CO3溶液中进行反应,并用数字化实验装置pH传感器测定了溶液中pH的变化。采集数据得到曲线如下图所示。
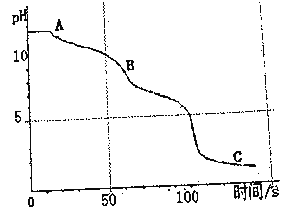
(3)0-50s时,同学们观察到溶液中并没有想象中的气泡产生,请你写出AB段发生反应的化学方程式:__________________。
(4)B点溶液pH大于7,是因为___________(填物质名称)的水溶液呈碱性。
(5)C点所得溶液的溶质是__________________。