题目内容
【题目】某研究小组对铁制品锈蚀相关问题进行探究。

实验一:探究氧气浓度对铁制品锈蚀的影响
(1)仪器a的名称为______。
(2)写出实验室用高锰酸钾制取氧气的化学方程式:______,发生装置应选______(填装置编号)。
(3)收集氧气浓度不同的混合气体(含氮气和氧气),可选用的装置是______(填装置编号)。
(4)设计实验探究氧气浓度对铁制品锈蚀快慢的影响。请简述实验方案(操作步骤、需控制的变量、应观察的现象,可结合图示说明) ___________。
实验二:探究铁锈的成分
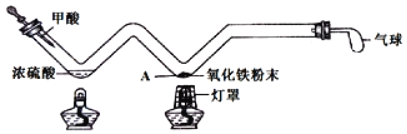
若铁锈成分为FexOy·nH2O,用下图所示装置(夹持仪器己省略)进行实验(每步反应和吸收均完全)。FexOy·nH2O受热容易分解产生水蒸气。无水硫酸铜能吸收水而变蓝,碱石灰既能吸收水也能吸收CO2。

(5)指出上图所示实验装置的一个明显缺陷 ______。
(6)加热前,先通CO气体一段时间,目的是______。
(7)为确定铁锈组成,将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,实验过程测得以下数据(忽略玻璃管中残留水蒸气):
铁锈样品的质量/g | 装置A的质量(不包括喷灯)/g | 装置B的质量/g | |
反应前 | 23.2 | 258.1 | 232.4 |
反应后 | 246.1 | 239.6 |
根据以上数据计算该铁锈样品中Fe元素质量为_____g,n的值为______。
【答案】锥形瓶 2KMnO4![]() K2MnO4+MnO2+O2↑ A E 在相同环境下,在规格相同的密闭集气瓶中,收集氧气浓度不同的混合气体,预留相同量的水,放入相同的铁钉,且铁钉露出相同长度;放置相同的时间后,比较铁钉锈蚀程度。根据铁钉锈蚀程度不同,判断氧气浓度不同对铁制品锈蚀快慢的影响 没有对一氧化碳进行尾气处理,会造成大气污染 排出装置内的空气,防止加热时发生爆炸 11.2 4
K2MnO4+MnO2+O2↑ A E 在相同环境下,在规格相同的密闭集气瓶中,收集氧气浓度不同的混合气体,预留相同量的水,放入相同的铁钉,且铁钉露出相同长度;放置相同的时间后,比较铁钉锈蚀程度。根据铁钉锈蚀程度不同,判断氧气浓度不同对铁制品锈蚀快慢的影响 没有对一氧化碳进行尾气处理,会造成大气污染 排出装置内的空气,防止加热时发生爆炸 11.2 4
【解析】
(1)仪器a 的名称是锥形瓶。
(2)高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,反应的方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑。该反应的反应物的状态是固态,反应的条件是加热,故选固固加热型装置A。
K2MnO4+MnO2+O2↑。该反应的反应物的状态是固态,反应的条件是加热,故选固固加热型装置A。
(3)氧气和氮气的密度比水的密度小,难溶于水,故气体要从短管通入,水从长管排出,故选E。
(4)在相同环境下,在规格相同的密闭集气瓶中,收集氧气浓度不同的混合气体,预留相同量的水,放入相同的铁钉,且铁钉露出相同长度;放置相同的时间后,比较铁钉锈蚀程度。根据铁钉锈蚀程度不同,判断氧气浓度不同对铁制品锈蚀快慢的影响
(5)该实验中有一氧化碳气体参加,一氧化碳是有毒的气体,如直接排放到空气中会造成空气污染,故该装置缺少尾气处理装置。
(6)一氧化碳是可燃性气体,如一氧化碳中混有氧气,温度达到一氧化碳的着火点,则一氧化碳会燃烧,引起爆炸,故要先通入一段时间的一氧化碳,排尽管中的空气,防止加热时发生爆炸。
(7)硬质玻璃管内发生反应的化学方程式为:FexOynH2O+yCO![]() xFe+yCO2+nH2O,根据实验数据可知,反应中生成水的质量为:(239.6g-232.4g)=7.2g,玻璃管的质量为:258.1g-23.2g=234.9g,反应后生成铁的质量为:246.1g-234.9g=11.2g。由于反应前后元素的种类与质量不变,所以23.2gFexOynH2O中含铁元素的质量为11.2g;含有“H2O”部分质量为7.2g;则余下的氧元素质量为:23.2g-11.2g-7.2g=4.8g
xFe+yCO2+nH2O,根据实验数据可知,反应中生成水的质量为:(239.6g-232.4g)=7.2g,玻璃管的质量为:258.1g-23.2g=234.9g,反应后生成铁的质量为:246.1g-234.9g=11.2g。由于反应前后元素的种类与质量不变,所以23.2gFexOynH2O中含铁元素的质量为11.2g;含有“H2O”部分质量为7.2g;则余下的氧元素质量为:23.2g-11.2g-7.2g=4.8g
则:x:y:n=![]() :
:![]() :
:![]() =2:3:4,则FexOynH2O的化学式为Fe2O34H2O.故n=4.
=2:3:4,则FexOynH2O的化学式为Fe2O34H2O.故n=4.