题目内容
【题目】结合下列给出的实验仪器,回答在实验室里制取氧气并完成其性质实验的有关问题。
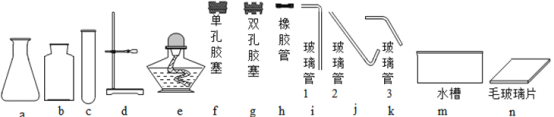
(1)仪器a的名称是________;
(2)利用高锰酸钾制取氧气,并用排水法收集氧气
①若要制取两瓶氧气(总质量为3.2g),至少需要________g的KMnO4完全分解;
②组装完整装置时,需要上图给出的仪器中的b、d、f、h、j、k、m、n和_______;
(3)选择气体的制取装置时,需要考虑________,反应条件和气体的性质。
【答案】锥形瓶 31.6 c、e 反应物状态
【解析】
(1)a是作为常温反应装置的锥形瓶;
(2)①设所需高锰酸钾质量为m,
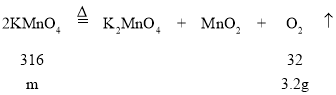
![]()
m=31.6,所以所需高锰酸钾质量为31.6g;
②高锰酸钾加热制取氧气,除了上述装置,还需要酒精灯加热,试管作为发生装置,所以为c、e;
(3)高锰酸钾是固体需要加热制取氧气,而过氧化氢溶液加入二氧化锰,则是固液不需要加热就可以制取氧气,所以反应物状态可以决定发生装置是加热装置还是不加热装置。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
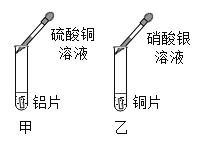
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】(1)在化学课上,甲同学将燃烧的钠迅速伸人到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出问题]黑色颗粒和白色物质是什么?
[进行猜想]甲认为黑色颗粒是碳,白色物质可能是Na2O或Na2O和Na2CO3或____________________,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是____________________________________。
[查阅资料]氧化钠为白色粉末,溶于水生成氢氧化钠: ![]() ;常温下饱和Na2CO3溶液的PH值约为12。
;常温下饱和Na2CO3溶液的PH值约为12。
[实验探究]甲同学对白色物质进行实验探究。
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ① 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2 溶液 | 出现白色沉淀 | 白色物质是Na2CO3 |
② 静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
[反思评价]丙同学认为方案1得到的结论不正确,其理由是___________________________。
[得出结论]钠在二氧化碳中燃烧的化学方程式为__________________________。
(2)某研究性学习小组设计了用沉淀法测定纯碱( Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案
[实验原理]利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数
[实验步骤]
①托盘天平称取样品22.0g放人烧杯中,加水使其完全溶解
②验证Na2CO3已完全反应的方法是:静置,向上层清液中滴加____________溶液,如果没有白色沉淀生成,即可证明;
③过滤、操作X、干燥、称量沉淀的质量为20.0g,操作X的名称是___________,如果缺少此操作会造成碳酸钠质量分数___________(填“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为多少?_____