题目内容
【题目】(6分)为了维护南海权益,我国去年宣布成立了三沙市。这是维护国家主权的象征,同时也是因为海洋资源十分丰富,有广泛的利用价值。其中通过海水晾晒即可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
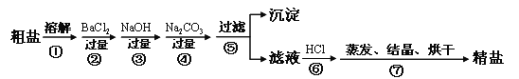
(1)根据以上信息,请写出海水中所含的主要阴离子的符号 。
(2)在上述流程中第③步加过量NaOH的目的是除去海水中的 (填离子符号,下同),第④步加过量Na2CO3的目的是除去海水中的 。第⑥步其实显示的是加适量盐酸,其目的是除去多余的 。
(3)请写出第②步所发生反应的化学方程式 。
(4)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是 。
【答案】(1)Cl- 、SO42-
(2)Mg2+ 、Ca2+ ; CO32- 、OH-
(3)BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
(4)用KOH会引入新杂质。
【解析】
试题分析:(1)由题意可知,海水中所含的主要阴离子是Cl-、SO42-;
(2)由于氯化镁与氢氧化钠的反应生成了氢氧化镁沉淀.所以,第③步加过量NaOH的目的是除去海水中的Mg2+;由于氯化钙与碳酸钠的反应生成了碳酸钙沉淀,所以,第④步加过量Na2CO3的目的是除去海水中的 Ca2+;由于盐酸与碱、碳酸盐的反应,所以,第⑥步其实显示的是加适量盐酸,其目的是除去多余的OH-、CO32-;
(3)在第②步中硫酸钠与氯化钡反应生成了硫酸钡沉淀和氯化钠,反应的方程式是:Na2SO4+BaCl2=BaSO4↓+2NaCl;
(4)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是:如果用KOH代替NaOH,最得到的精盐中含有氯化钾.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

