题目内容
【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究
(实验探究1)向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
(查阅资料)
pH值 | 7.5-9 | 10-11.9 | 12-14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
(得出结论1)三种溶液的碱性由强到弱的顺序为_________。
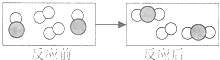
(实验探究2)甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由_____色变为_____色。向其中加入稀盐酸,该反应的化学方程式为__________。乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示。
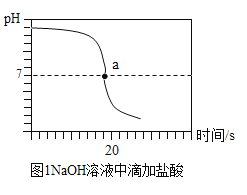
a点表示的含义是___________。
(得出结论2)从微观角度分析,该反应的实质是_________。
【答案】氢氧化钠溶液>碳酸钠溶液>碳酸氢钠溶液 无 红 NaOH+HCl=NaCl+H2O 氢氧化钠和盐酸刚好完全反应,溶液呈中性,pH等于7 氢离子和氢氧根离子结合生成水分子
【解析】
[得出结论1]
由上面提供的信息可知,加入紫甘蓝汁液时,溶液显黄色时的碱性比显绿色时强,显绿色时碱性比显蓝色时强,因此三种溶液的碱性由强到弱的顺序为氢氧化钠溶液>碳酸钠溶液>碳酸氢钠溶液。
[实验探究2]
甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由无色变为红色;
向其中加入稀盐酸时,氢氧化钠和稀盐酸反应生成氯化钠和水,该反应的化学方程式为:NaOH+HCl=NaCl+H2O;
a点表示的含义是氢氧化钠和盐酸刚好完全反应,溶液呈中性,pH等于7。
[得出结论2]
从微观角度分析,该反应的实质是氢离子和氢氧根离子结合生成水分子。

 阅读快车系列答案
阅读快车系列答案