题目内容
【题目】海洋是人类千万年来取之不尽、用之不竭的巨大资源宝库,开发前景广阔。
(1)目前海水淡化的方法很多,在世界范围之内能做到规模化和产业化的主要是膜法和______。高压反渗透膜法淡化海水是利用海水中各成份的_________不同分离出淡水。
(2)2017年5月18日,在中国南海海域实现可燃冰(CH4·nH2O)试采成功,这将使人类能源格局翻开新篇章。

①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N2、CO2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于_____(选填“纯净物”或“混合物”)。
②若某种可燃冰中CH4与H2O的质量比是1:9,则该可燃冰中n=_______。
(3)海水“晒盐”
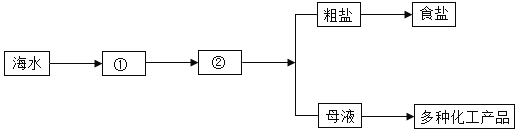
①海水提取食盐的方法主要为“盐田法”,其过程如下;图中②是_____池,下图中的“母液”是氯化钠的_________溶液。(填“饱和”或“不饱和”)
②粗盐纯化。粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后通过如下操作即可得到较纯的氯化钠:a过滤;b加过量的Ba(OH)2溶液;c加适量的盐酸;d加过量的Na2CO3溶液;e蒸发。正确的操作顺序是_________(填字母)。
(4)制镁。工业上一般用电解熔融状态的氯化镁制金属镁,若以卤水(含有硫酸镁、氯化钠和氯化钙)为起始原料来制取金属镁。
①从海水中提取镁过程中涉及到的分解反应的化学反应方程式为__________。
②海水本身就是含有MgCl2的溶液,它与通过转化后得到的MgCl2溶液有何不同:_________。
【答案】热法 颗粒大小 混合物 8 结晶 饱和 bdace  海水中含有很多杂质,而通过转化后的MgCl2溶液较为纯净
海水中含有很多杂质,而通过转化后的MgCl2溶液较为纯净
【解析】
(1)目前海水淡化的方法很多,在世界范围之内能做到规模化和产业化的主要是膜法和热法;高压反渗透膜法淡化海水是利用海水中各成份的颗粒大小的不同;
(2)①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N2、CO2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于混合物;
②若某种可燃冰中CH4与H2O的质量比是1:9,CH4的相对分子质量为16, H2O的相对分子质量为18,n=![]() ,故该可燃冰中n=8;
,故该可燃冰中n=8;
(3)①海水引入蓄水池,经过蒸发池蒸发水分,再经过结晶池结晶析出氯化钠,此时的母液对于氯化钠来说是饱和溶液,故图中②是结晶池,下图中的“母液”是氯化钠的饱和溶液;
②镁离子用氢氧根离子沉淀,加入过量的氢氧化钡可以将镁离子沉淀;加入过量的碳酸钠可以将钙离子沉淀;加入的碳酸钠要放在加入的氢氧化钡之后,这样碳酸钠会除去反应剩余的氢氧化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后再蒸发。故正确的操作顺序为bdace;
(4)①从海水中提取镁过程中涉及到的分解反应的化学反应方程式为氯化镁电解生成镁和氯气,反应的化学方程式为 ;
;
海水本身就是含有MgCl2的溶液,它与通过转化后得到的MgCl2溶液不同点在于海水中含有很多杂质,而通过转化后的MgCl2溶液较为纯净。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究
(实验探究1)向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
(查阅资料)
pH值 | 7.5-9 | 10-11.9 | 12-14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
(得出结论1)三种溶液的碱性由强到弱的顺序为_________。
(实验探究2)甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由_____色变为_____色。向其中加入稀盐酸,该反应的化学方程式为__________。乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示。
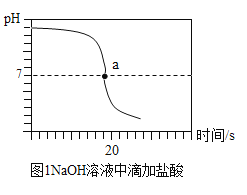
a点表示的含义是___________。
(得出结论2)从微观角度分析,该反应的实质是_________。
【题目】氧气是我们身边无法离开的物质。某兴趣小组对氧气进行了一系列研究。
Ⅰ.氧气的制备
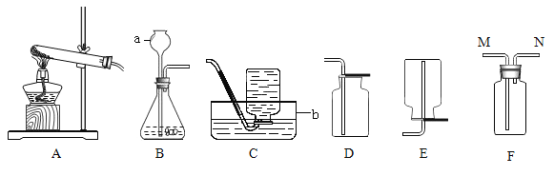
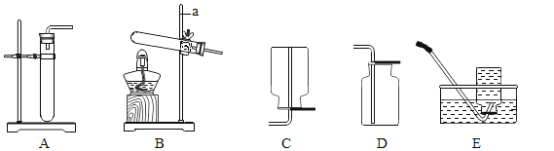
(1)写出图中有标号仪器的名称a__________________,b___________________。
(2)用A装置制取氧气,写出反应的化学方程式:___________________,
(3)用双氧水和二氧化锰制取氧气的化学方程式为_____________________, 反应后过滤、干燥,所得到的二氧化锰____________________(填 “能”或“不能”)继续作为双氧水分解的催化剂。
Ⅱ .氧气的收集
(1)装置C、D、E、F在实验室不能用来收集氧气的是____________________(填字母编号)。
[实验一]用D装置收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验三次。
[实验二]用D装置收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40 秒,测定瓶中氧气的含量,重复实验三次。
[实验三]用排水法收集氧气,测定瓶中氧气的含量,重复实验三次。
实验数据:
实验1 | 实验2 | 实验3 | |||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | ||||||
数据分析:
(2)由实验1、 2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是___________________,
(3)不考虑操作及药品因素,实验3获得的氧气体积分数不能达到100%的主要原因是____________________。
Ⅲ.铁丝在氧气中燃烧
做完“铁在氧气里燃烧”的实验后,同学们对铁燃烧时溅落下来的黑色物质产生了疑问。
[问题一]铁燃烧时溅落下来的黑色物质中还有没有铁?
[查阅资料1]①氧化亚铁极易被氧化为氧化铁,因此自然界中铁的氧化物主要有氧化铁和四氧化三铁两种:②氧化铁为红棕色固体,不能被磁铁吸引,铁和四氧化三铁能被磁铁吸引;③铁能和稀盐酸反应生成氢气,铁的氧化物也能和稀盐酸反应,但无气体产生。
[实验探究]将铁丝燃烧后得到的黑色物质冷却,然后研碎,________________________,说明溅落下来的黑色物质中含有铁。
[问题二]铁燃烧的产物为什么不是氧化铁呢?
[查阅资料2]
①氧化铁和四氧化三铁分解温度见下表:
②氧化铁高温分解成四氧化三铁。
四氧化三铁 | 氧化铁 | 铁 | |
分解温度/°C | 1538 | 1400 | / |
熔点/°C | / | / | 1535 |
[理论讨论]根据上述探究及实验现象,并结合表中数据分析,可推知铁在氧气里燃烧时产生的高温在___________________________,之间,此温度范围氧化铁已分解。
[拓展延伸]
(1)氧化铁高温分解可生成四氧化三铁和一种气体,写出该反应的化学方程式____________________________,
(2)有些食品包装盒内放有少量黑色的氧化亚铁,若粉末的颜色___________________________,就说明包装盒漏气,售货员就能及时发现并处理。