题目内容
【题目】有一含有纯碱的食盐样品,某同学称取30g的样品放入烧杯中,向烧杯中加入100g足量的稀盐酸,充分反应后气体全部逸出,烧杯中剩余物的总质量为125.6g.
(1)反应生成气体的质量是______g.
(2)反应后所得溶液中溶质的质量分数是多少_____?(精确到0.1%)
【答案】4.4 24.8%
【解析】
(1)根据质量守恒定律,可得出生成的二氧化碳的质量为:30g+100g-125.6g=4.4g;
(2)设30g样品中碳酸钠的质量为x,生成NaCl的质量为y。
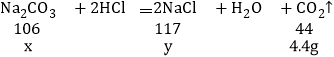
![]()
x=10.6g
y=11.7g
所得溶液中氯化钠的质量质量分数![]() ×100%≈24.8%
×100%≈24.8%
答:(1)反应生成气体的质量是4.4g;(2)反应后所得溶液中溶质的质量分数24.8%。

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
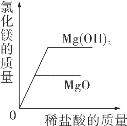
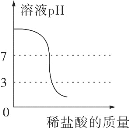
【题目】老师在课堂上演示了如图甲、乙两个实验并对实验现象进行了分析然后把甲、乙反应后的溶液倒入同一个烧杯中发现有白色沉淀生成,于是大家对白色沉淀的成分进行如下探究。

(查阅资料)硫酸钡不溶于水也不溶于酸。
(实验分析)甲实验中发生反应的化学方程式为_____。
(提出问题和猜想)烧杯中白色沉淀的成分是什么呢?
猜想:BaSO4
猜想Ⅱ:Mg(OH)2和BaSO4;
猜想Ⅲ:Cu(OH)2和BaSO4;
同学们经过讨论认为猜想Ⅲ错误,其理由是_____。
(实验方案)
实验操作 | 实验现象与结论 |
过滤洗涤白色沉淀然后向白色沉淀中加入 盐酸至过量 | _____,猜想Ⅱ成立; |
(拓展与思考)要证明乙试管中硫酸溶液是否有剩余可采用的不同类别的试剂有①_____,②_____。(不能选用题中已用试剂)