题目内容
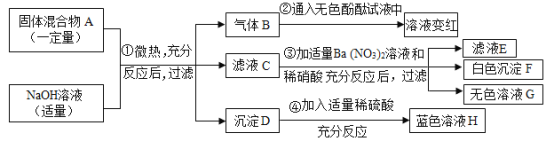
【题目】现欲探究一固体混合物 A 的成分,已知其中可能含有 CaCO3、MgSO4、NH4Cl、Cu 四种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
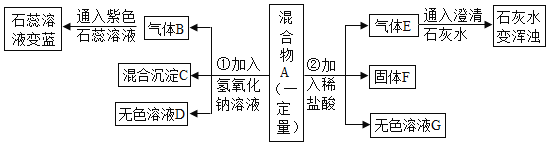
试根据实验过程和发生的现象填写以下空白:
(1)气体 E 的化学式为____________________。
(2)写出实验过程①中一定发生反应的化学方程式:________________。
(3)混合沉淀 C 中至少含有_________________种物质。
(4)混合物A 中,还不能确定存在的物质是________________(写化学式)。要进一步确定其是否存在,可用无色溶液 D 进行再实验,请补充完整实验操作步骤、发生的现象及结论:取少量溶液 D 于试管中,____________。
【答案】CO2 ![]() 2 MgSO4 滴加 BaCl2(或 Ba(NO3)2 或 Ba(OH)2)溶液,若有白色沉淀产生,则含有MgSO4;若无沉淀生成,则不含 MgSO4
2 MgSO4 滴加 BaCl2(或 Ba(NO3)2 或 Ba(OH)2)溶液,若有白色沉淀产生,则含有MgSO4;若无沉淀生成,则不含 MgSO4
【解析】
(1)将气体E通入澄清石灰水中,澄清石灰水变浑浊,说明气体E是二氧化碳,化学式为:CO2;
(2)混合物A中加入氢氧化钠,有气体生成,且该气体能使紫色石蕊溶液变蓝,可推出气体B为氨气,说明混合物中含氯化铵,氯化铵与氢氧化钠反应生成氨气、氯化钠和水,故实验过程①中一定发生反应的化学方程式为:![]() ;
;
(3)向混合物A中加入稀盐酸,有二氧化碳气体生成,说明混合物中含碳酸钙,因为碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,有固体F产生,铜不与稀盐酸反应,故F为铜,向混合物中加入氢氧化钠,有氨气产生,说明含氯化铵,无法确定是否含硫酸镁,故混合沉淀 C 中至少含有碳酸钙、铜两种物质;
(4)由以上分析可知,混合物A 中,还不能确定存在的物质是:MgSO4;
硫酸根离子可与钡离子结合成硫酸钡沉淀,故为确定是否含硫酸镁,可取少量溶液 D 于试管中,滴加 BaCl2(或 Ba(NO3)2 或 Ba(OH)2)溶液,若有白色沉淀产生,则含有MgSO4;若无沉淀生成,则不含 MgSO4。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:

部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
(1)熟石灰主要成分的化学式是____________。
(2)溶液A中的阳离子是___________________(填离子符号)。
(3)沉淀C的成分是_____________________。
(4)溶液B与熟石灰反应的化学方程式是____________________________________。
【题目】2018年5月18日我国第一艘国产航母海试成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为__g。
(2)第三次实验后溶液中的溶质是___。
(3)该黄铜中铜的质量分数为多少__?(写 出计算过程)
【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液)。四组实验数据记录如右表。请分析计算:
(1)反应后,稀盐酸还有剩余的是第______组。
(2)求混合物中碳酸钙和氯化钙质量之比。
(3)表中a的值为_____。
(4)求表中m的值。
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g' | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/ | 0 | 0 | m | n |