题目内容
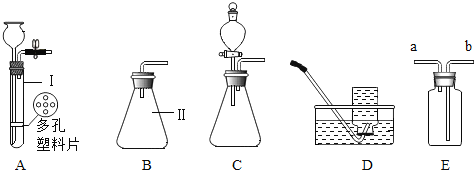
【题目】实验室里有一包含有NaCl和CaCl2两种固体的混合物,现准备将它们分离开,设计如下方案。
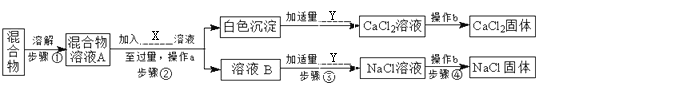
请完成下列问题:
(1)步骤②中发生反应的化学方程式是________________。操作b的名称是______。
(2)步骤③中加适量Y的作用是______________。
(3)在步骤④操作b中, 盛装NaCl溶液的仪器名称是__________,此操作中玻璃棒的作用是______。
【答案】 Na2CO3 + CaCl2 =CaCO3↓ +2NaCl 蒸发 反应过量的Na2CO3溶液 。 蒸发皿 , 搅拌,使受热均匀 。
【解析】(1)NaCl和CaCl2混合物样品加入过量的碳酸钠溶液,氯化钠不反应,氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,方程式是:Na2CO3+CaCl2═CaCO3↓+2NaCl;通过操作a固体和液体分离开来,因此操作a是过滤;碳酸钙和盐酸发生反应得到氯化钙溶液,经蒸发可得到氯化钙固体;操作b的名称是蒸发;(2)由于碳酸钠过量,所以通过a过滤后的溶液B中含有氯化钠和过量的碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,加入稀盐酸,碳酸钠和稀盐酸生成氯化钠和水和二氧化碳,盐酸中的溶质是氯化氢气体,蒸发时氯化氢挥发出去,蒸发后最后的固体物质是氯化钠。所以:步骤③中所加适量试剂是稀盐酸,作用是除去过量的碳酸钠;(3)步骤④要由氯化钠溶液得到氯化钠固体,操作是蒸发结晶,蒸发使用的仪器是蒸发皿,该操作中玻璃棒的作用是搅拌,使液体受热均匀,防止液滴飞溅。

 阅读快车系列答案
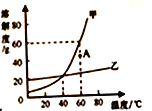
阅读快车系列答案【题目】下表是NaCl、KNO3在不同温度时的溶解度:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
据此数据,判断下列说法错误的是
A. KNO3和NaCl的溶解度曲线在20℃—30℃温度范围内会相交
B. 在60℃时,KNO3的饱和溶液105g加入95g水后,溶液中溶质的质量分数为27.5%
C. 在20℃时,NaCl和KNO3固体各35g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液
D. 从含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法