题目内容
【题目】化学是一门以实验为基础的学科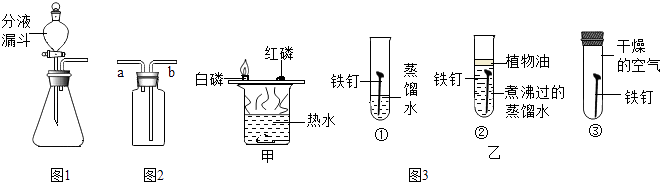
(1)【实验一】常见气体的制取
若用如图1装置制取氧气,则分液漏斗中盛放 , 在锥形瓶中盛放 .
(2)若用图1装置制取二氧化碳,则装置中发生反应的化学方程式是 .
(3)【实验二】图2装置有多种用途
收集气体:气体从a端进入收集,该气体必须具有的性质是 .
(4)干燥气体:除去二氧化碳中的水蒸气,则装置中应盛放(填“浓硫酸”或“NaOH溶液”)
(5)贮存气体:用水将瓶中贮存的气体排出使用,水从(填“a”或“b”)端进入.
(6)【实验三】控制变量法是实验探究的重要方法
图3甲中比较铜片上白磷和红磷的不同现象可以说明可燃物燃烧需要 .
(7)图3乙中①②③对比可以探究铁的锈蚀与、有关.
【答案】
(1)过氧化氢溶液,二氧化锰
(2)CaCO3+2HCl=CaCl2+CO2↑+H2O
(3)密度比空气小
(4)浓硫酸
(5)b
(6)温度达到着火点
(7)水,氧气(空气)
【解析】解:(1)若用如图1装置制取氧气,为过氧化氢与二氧化锰制取氧气,分液漏斗中盛放过氧化氢溶液,在锥形瓶中盛放二氧化锰;(2)二氧化碳的实验室制法是用稀盐酸与大理石(或石灰石.其主要成分都是碳酸钙)反应来制取.其反应原理是CaCO3+2HCl=CaCl2+CO2↑+H2O;(3)据图2装置从a进入,气体必须具备密度比空气小的性质;(4)浓硫酸具有吸水性,可干燥氧气、二氧化碳等,除去二氧化碳中的水蒸气,则装置图2中应盛放浓硫酸;(5)用水将瓶中贮有的气体排出使用,水从b端进入.因为水的密度比气体的大,水从b端进入瓶内后,瓶内的气体就会被排出瓶外使用了;(6)燃烧的条件:物质具有可燃性、与氧气接触、温度达到可燃物的着火点.铜片上的白磷能与氧气接触,发生了燃烧;而红磷没有燃烧,得出燃烧的条件之一:可燃物温度达到着火点.(7)①铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果;②中铁钉能与蒸馏水接触,但不能与空气接触,而③中的铁钉能与空气接触,但不能与水接触,故图3乙中①②③对比可以探究铁的锈蚀与水和氧气(空气)有关.所以答案是:(1)过氧化氢溶液、二氧化锰;(2)CaCO3+2HCl=CaCl2+CO2↑+H2O;(3)密度比空气小;(4)浓硫酸;(5)b;(6)温度达到着火点;(7)水和氧气(空气).
【考点精析】掌握分离物质的仪器和氧气的制取装置是解答本题的根本,需要知道分离物质及加液的仪器--漏斗、长颈漏斗;过滤时,应使漏斗下端管口与承接烧杯内壁紧靠,以免滤液飞溅.长颈漏斗的下端管口要插入液面以下,以防止生成的气体从长颈漏斗口逸出;发生装置:固固加热型、固液不加热型.