题目内容
【题目】通过海水提取的粗盐中含有MgCl2、CaCl2、MgSO4。以及泥沙等杂质。以下是一种制备精盐的实验方案(用于沉淀的试剂均过量)。
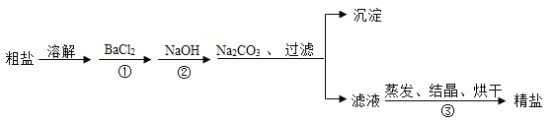
请回答下列问题:
(1)步骤①中的BaCl2不能改成Ba(NO3)2,其原因是什么?___________________
(2)进行步骤①后,如何判断BaCl2是否过量?_______________________________
(3)加入Na2CO3的目的是什么?_______________________________________
(4)以上粗盐提纯的有关操作中需用到的主要仪器有哪些?____________________
(5)该实验方案还需完善,请写出具体的操作步骤。_____________
【答案】会引入新的杂质离子NO3- 取少量上层清液,继续滴加BaCl2溶液,如没有白色沉淀出现,则说明BaCl2过量 除去Ca2+、Ba2+ 烧杯、玻璃棒、漏斗、蒸发皿、酒精灯、铁架台、坩埚钳等 还应在滤液中加入适量的稀盐酸以除去氢氧化钠和碳酸钠
【解析】
(1)在除杂质的同时不能引入新的杂质,硝酸钡和硫酸镁生成硫酸钡和硝酸镁,故原因是会引入新的杂质离子NO3-
(2)利用硫酸根离子检验钡离子的存在,故判断BaCl2是否过量的方法是取少量上层清液,继续滴加BaCl2溶液,如没有白色沉淀出现,则说明BaCl2过量
(3)在②步后,溶液中存在的物质有:未反应的氯化钡、氯化钙,需要将钡离子和钙离子除去,故加入Na2CO3的目的是除去Ca2+、Ba2+
(4)粗盐提纯的步骤为:溶解、过滤、蒸发,故粗盐提纯的有关操作中需用到的主要仪器有烧杯、玻璃棒、漏斗、蒸发皿、酒精灯、铁架台、坩埚钳等
(5)过滤前的溶液中加入的碳酸钠和氢氧化钠都是过量的,反应后两者都有剩余,需要加入一种试剂将溶液中的碳酸根离子和氢氧根离子除去,故还应在滤液中加入适量的稀盐酸以除去氢氧化钠和碳酸钠