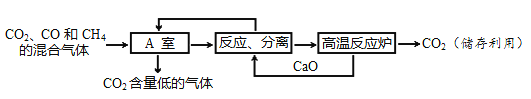
题目内容
【题目】金属钠投入到NH4Cl溶液中,钠浮在液面上,熔成小球,四处游动,并生成大量气体。为确定气体的成分,进行下列实验探究.
(1)猜想:气体可能是HCl、NH3、H2中的一种或几种,作此猜想的理论依据是________________。
(2)实验:甲同学为判断气体成分,查阅资料得知:2NH3+3CuO![]() 3Cu+N2+3H2O。于是设计了如图实验装置:
3Cu+N2+3H2O。于是设计了如图实验装置:
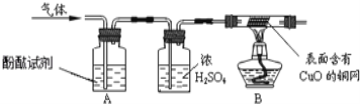
(3)现象与结论:A中观察到酚酞试剂变为红色,证明有______;B中玻璃管内观察到固体表面由黑色变红色,证明有_______。
(4)实验反思:
①浓硫酸的作用是_________________。
②乙同学认为甲的设计不能确定是否含有HCl,于是他将气体通入混有稀硝酸的________溶液中,无白色沉淀产生,则该气体中_____HCl(填“有”或“无”)。
③请完善Na与NH4Cl溶液反应的化学方程式2Na+2NH4Cl=2NH3↑+H2↑+2________。
(5)已知2.3g的钠与一定量的溶质质量分数为10%的氯化铵溶液正好完全反应,求反应后所得氨气的质量是多少?______
【答案】 化学反应前后元素种类保持不变 NH3 H2 吸收氨气和水 硝酸银 无 NaCl 1.7g
【解析】(1). 化学反应前后元素种类保持不变 ,NH4Cl由氯、氮、氢三种元素组成, HCl、NH3、H2的组成元素复合,且都是气体; (3) NH3 和水反应生成氨水,溶液呈碱性,使酚酞试液变红;A中观察到酚酞试剂变为红色,证明有氨气; (3). 氨气易溶于水,能与硫酸反应,所以气体通入B之前氨气被除尽,则B中玻璃管内观察到固体表面由黑色变红色,证明有还原性气体H2 (4). ①硫酸和氨气反应生成硫酸铵,而吸收氨气,同时浓硫酸是干燥剂,可以吸收吸收气体中的水 ②硝酸银能和盐酸反应生成氯化银白色沉淀,将气体通入混有稀硝酸的硝酸银溶液中,无白色沉淀产生,则该气体中无HCl ;③ 据质量守恒定律可知,反应前后原子的种类、个数不变,因此化学式为 NaCl ; 设氨气的质量为x,则
2Na + 2NH4Cl = 2NH3↑+H2↑+2 NaCl
46 34
2.3g x
46/2.3g=34/x
X=1.7g
答:略

【题目】下列四个图像反映了对应实验过程中相关量的变化,其中错误的是
|
|
|
|
A.部分变质的NaOH溶液中滴加稀盐酸 | B.HCl气体的溶解度受温度影响的变化曲线 | C.等质量的Mg粉和Fe粉与足量相同浓度的稀盐酸反应 | D.硫酸溶液稀释过程中pH的变化曲线 |
A. A B. B C. C D. D
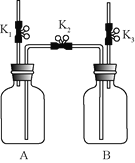
【题目】利用下图装置进行实验。实验前![]() 、
、![]() 、
、![]() 均已关闭。
均已关闭。
内容 装置 | 【实验1】制备气体 | 【实验2】测定气体含量 |
| Ⅰ.打开 Ⅱ.在 | Ⅰ.A(容积 Ⅱ.打开 |
(1)检查装置气密性:保持![]() 关闭,打开
关闭,打开![]() 、
、![]() ,向B中加水至液面浸没下端导管口,用手捂住A瓶外壁,说明装置在左侧气密性良好的现象是_______;用同样原理可以检查装置另一侧的气密性。
,向B中加水至液面浸没下端导管口,用手捂住A瓶外壁,说明装置在左侧气密性良好的现象是_______;用同样原理可以检查装置另一侧的气密性。
(2)实验1中,锌与稀硫酸反应的化学方程式为________;气体收集完毕后,在不拆卸装置的情况下,使A中未反应的稀硫酸大部分转移到B中的操作是___________。
(3)实验2中,当B中液面不再变化时,测得B中减少了160mL水,则A中![]() 的体积分数约为___________%。
的体积分数约为___________%。