题目内容
【题目】小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末15g,向其中逐渐加入一定溶质质量分数的稀硫酸,反应前后质量关系如图所示。请完成下列计算。
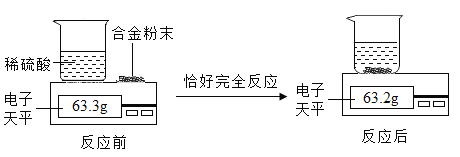
(1)反应生成氢气的质量为______g。
(2)计算合金中铜的质量________。
(3)反应后所得溶液中溶质的质量分数________(计算结果保留一位小数)。
【答案】0.1 11.75g 15.6%
【解析】
(1)根据质量守恒定律,反应生成氢气的质量为63.3g-63.2g=0.1g;故填:0.1.
(2)设合金中锌的质量为x,反应生成的硫酸锌的质量为y,
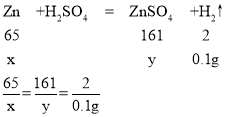
解得x=3.25g y=8.05g
合金中铜的质量为15g-3.25g=11.75g
答:合金中铜的质量为11.75g。
(3)反应后所得溶液中溶质的质量分数为![]()
答:反应后所得溶液中溶质的质量分数为15.6%。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
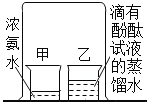
普通高中同步练习册系列答案【题目】某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现 象:将酚酞试液滴人某 NaOH 溶液中,溶液变成了红色,可过一会儿红色却消失了。
(提出问题)是什么原因导致滴有酚酞的 NaOH 溶液由红色褪为无色?
(猜想与假设)他们分别对这种意外现象作如下猜想: 甲同学:可能是酚酞与 O2 发生了反应;
乙同学:可能是 NaOH 溶液与空气中的 CO2 发生了反应; 丙同学:可能与 NaOH 溶液浓度大小有关; 你认为可能还与__________________有关(写一条即可)。
(设计实验)三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 设计这一步骤的目的 | 实验现象 | 实验结论 |
1.将 NaOH 溶液加热煮沸 | _________________ | 溶液变 红,过一 会儿红色 消失 | 甲同学猜想_________________(填“正确”或 “不正确” ) |
2.向冷却后的溶液中滴人酚 酞,并滴一些植物油在其上方 | _________________ |
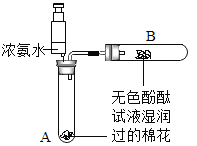
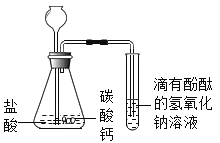
(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液 的红色褪去,于是认定自己的猜想正确 。请写出 CO2 与 NaOH 溶液反应的化学方程式:_________________。 甲同学认为乙同学的实验不够严谨,理由 是:__________________。
【题目】物质构成的奥秘,能帮助我们更好的认识物质变化的本质.
(1)根据原子结构示意图分析,不能确定的是________ (填字母)
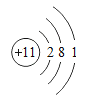
A 元素种类 B 原子的质子数 C 相对原子质量 D 元素的化学性质
(2)A、B、C、D表示四种物质,其微观示意图见下表.A、B在高温条件下反应能生成C和D。
物质 | A | B | C | D |
|
微观示意图 |
|
|
|
|
①四种物质中属于化合物的是________ (填字母,下同).
②该反应的化学方程式为________
③根据以上微观示意得出的下列说法中,正确的是 _______ .
A 分子、原子都可以直接构成物质 B 参加反应的B与生成物C的质量比为3:7
C D是一种理想的清洁燃料 D C物质有毒,排放到空气中会造成空气污染
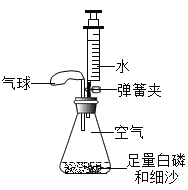
【题目】如图,在烧瓶内加适量固体X和液体Y,迅速套上气球,观察气球逐渐胀大。一段时间后打开弹簧夹,将注射器中液体Z注入烧瓶并振荡,气球缩小并被吸入烧瓶内。则X、Y、Z最合理的组合是( )
X | Y | Z | |
A | Zn | 稀盐酸 | 石灰水 |
B | CaO | 水 | 稀盐酸 |
C | Na2CO3 | 稀硫酸 | NaOH溶液 |
D | NaOH | 水 | 硝酸铵 |
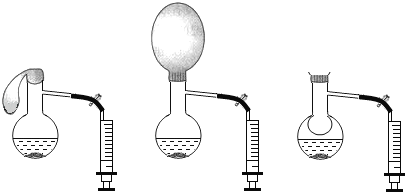
A.AB.BC.CD.D
【题目】某化学兴趣小组用化学方法测定一种钢样品中铁的含量,同学们称取了6.4g钢样品,投入装有50.0g稀盐酸的烧杯中恰好完全反应(假设样品中的其他物质不与酸反应)在实验过程中对烧杯(包括溶液和残余固体)进行四次称量,记录数据如下表:
反应时间/s | 0 | t1 | t2 | t3 |
烧杯和药品的质量/g | 85.4 | 85.3 | 85.2 | 85.2 |
请计算:
(1)反应生成氢气的质量为_____g。
(2)所用稀盐酸的溶质质量分数_____。