题目内容
【题目】下列说法中正确的是 ( )
A. 红磷在氧气中能燃烧,在空气中不能燃烧
B. 纯净的氢气在空气中燃烧发出淡蓝色火焰,放出热量
C. 镁条在氧气中燃烧时,火星四射,生成黑色固体
D. 铁丝伸入盛有氧气的集气瓶中剧烈燃烧,发出白光
【答案】B
【解析】A.红磷在氧气和空气中均可燃烧,在纯氧中燃烧更剧烈,故A错误;
B.纯净的氢气具有可燃性,与空气中的氧气发生发出淡蓝色火焰,生成无色液滴,放出热量,故B正确;
C.镁条在氧气中剧烈燃烧,发出耀眼的白光,生成白色固体,故C错误;
D.红热的铁丝伸入氧气的集气瓶中,剧烈燃烧,火星四射,放出热量,生成黑色固体,故D错误。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究_______________________对反应速率的影响.
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ.
【猜想Ⅱ】过氧化钙与水反应可制取氧气.
实验装置 | 实验主要过程 |
| ①检查装置气密性. ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体.该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出. |
实验结论:过氧化钙与水反应______(填“能”或“不能”)用于实验室制取氧气.
【分析与反思】
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为渔民用过氧化钙做增氧剂的主要原因是__________________.
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议___________.
(3)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气
你认为猜想_____(填序号)一定是错误的,理由是________________________.
【计算】该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示.试计算:

(1)过氧化钙的相对分子质量为_______;
(2)过氧化钙中钙元素与氧元素的质量比为________;
(3)____________g过氧化钙与100g碳酸钙CaCO3含钙量相当;
【题目】下列操作均有一处错误,将操作的错误之处及由此引起的后果填入表中:
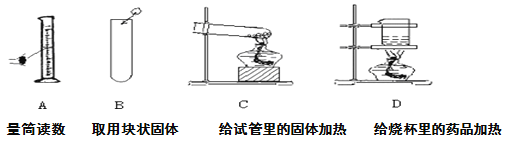
错误之处 | 造成主要后果 | |
A | ______________________ | ______________________ |
B | ______________________ | ______________________ |
C | ______________________ | ______________________ |
D | ______________________ | ______________________ |