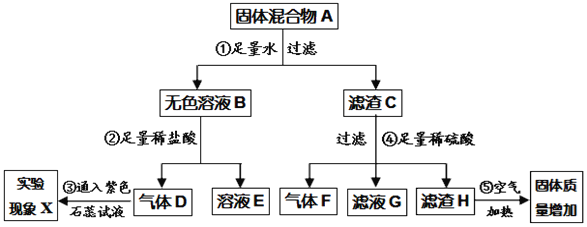
��Ŀ����
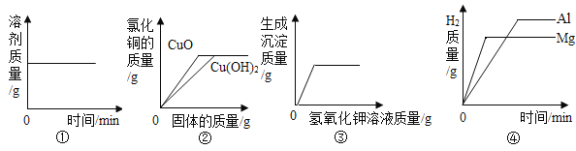
����Ŀ����Һ�����ǵ����������������.ͼ1Ϊ�ס������ֹ������ʵ��ܽ�����ߡ�
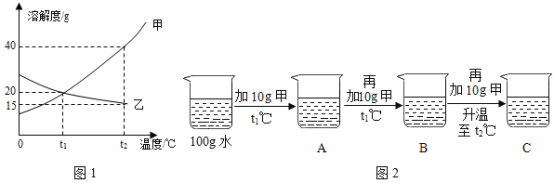
(1)�ܽ�����¶����߶������������___________ (�� ���ס����ҡ�) .
(2)ijͬѧ��ͼ2��ʾ����ʵ�飬�õ���Ӧ�¶��µ�A��B��C��Һ����A��B��C������Һ�����ڱ�����Һ����___________________(����ĸ)��
(3)��t2��Cʱ�ļף����������ʵı�����Һ������t1��C,������Һ�����ʵ�����������___�� (�<����=����>��)
���𰸡��� B >
��������
��1��������Ŀ��Ϣ���ܽ�����߿�֪���������ʵ��ܽ�ȣ������¶����߶������ҵ��ܽ�����¶ȵ����߶����٣�����ס�
��2��ijͬѧ��ͼ2��ʾ����ʵ�飬�õ���Ӧ�¶��µ�A��B��C��Һ����t1����ܽ��Ϊ20g��������A��B��C������Һ�����ڱ�����Һ����B����ΪB��Һ��ǡ�ôﵽ����״̬�����B��
��3����t2��ʱ�ļס����������ʱ�����Һ������t1����������Һ�����ʵ�����������>�ң���Ϊ�����ҵ������������䣬������С�����>��

����Ŀ��ijͬѧ�������ϵ�֪��ʵ���ҳ��õ�ʯ(��Ҫ�ɷ���CaC2)��ˮ��Ӧ��ȡ��Ȳ(C2H2)����Ӧ�Ļ�ѧ����ʽΪCaC2 +2H2O==Ca(OH) 2 +C2H2��(��ʯ�е����ʲ�����ˮ�Ҳ���ˮ��Ӧ��Ҳ����Na2CO3��Һ��Ӧ)����ʵ�����У���ͬѧ��һ������CaC2����Na2CO3��Һ�г�ַ�Ӧ����ˣ��õ���������Һ��������Һ�ijɷֽ���̽����
[�������]��Һ�����ʵijɷ���ʲô?
[���������]
����һ:NaOH
�����:NaOH��Na2CO3
������:NaOH��Ca(OH) 2
[ʵ����֤]
ʵ����� | ʵ����� | ʵ������ | ʵ����� |
ʵ��һ | ȡ������Һ���Թ��У������м������ϡ���� | �����ݲ��� | ����________������ |
ʵ��� | ȡ������Һ���Թ��У������еμ�����̼������Һ | _________ | ������������������Ӧ�Ļ�ѧ����ʽΪ_______ |
[��չ����]
(1)����CuCl2��Һ�м�������CaC2��ַ�Ӧ���ɹ۲쵽�����ݲ�������_______��
(2)ʵ���ұ����ʯӦע��__________________________��
����Ŀ��ͬѧ��������ʵ����ʱ������һ����ɫ��ĩ״ҩƷ����ʦ˵��ҩƷ���Ȼ��ơ�̼��ơ����������е�������ɣ�ͬѧ�ǶԴ˺ܺ��棬���Ƕ������ɫ��ĩ�ijɷֽ�������̽����
���������룩����һ��_______ �������CaCO3��NaOH ��������NaCl��NaOH
�����ʵ�飩
ʵ�鲽�� | ʵ������ | ʵ����� |
��1��ȡһ������ɫ��ĩ���ձ��У�������ˮ������ | ________ | ������������ |
��2��ȡ������1����������Һ���Թ��У������е����Ȼ�ͭ��Һ | ________ | ����������� |
��3����ȡ������1����������Һ���Թ��У������еμӹ�����____��Һ | ������ɫ���� | ����һ���� |
д�����裨3���з�����Ӧ�Ļ�ѧ����ʽ____��
����չ���죩��βⶨ�ð�ɫ��ĩ��̼��Ƶ����������أ�ijͬѧ����̼�������ϡ���ᷴӦ����������̼���ⶨ�ð�ɫ��ĩ��̼��Ƶ�������������������װ�òⶨ������̼��������
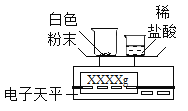
��1����С�ձ��е�����ϡ����ּ��μ��뵽���ձ��в����Ͻ��裬�жϰ�ɫ��ĩ��̼�����ȫ��Ӧ��ʵ��������_____��
��2����֪��Ӧǰ��������[m�����ձ�����ɫ��ĩ����m��С�ձ���ϡ���ᣩ]��Ҫ��������CO2�����������ٻ���Ҫ��������____������ţ���
A m��С�ձ��� B m�����ձ��� C m�����ձ�����Ӧ��ʣ���