题目内容
金属在生产生活中应用广泛.根据如图转化关系图,回答问题.
①铁生锈的条件是 .
②写出步骤Ⅱ中的化学方程式 .
③黄色溶液中的溶质是 .
④金属的回收和利用是保护金属资源的一种有效途径.将铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后,对剩余固体成分的判断正确的是 .
A.肯定有银 B.肯定有铜 C.可能有铁 D.可能是铁和银.

①铁生锈的条件是
②写出步骤Ⅱ中的化学方程式
③黄色溶液中的溶质是
④金属的回收和利用是保护金属资源的一种有效途径.将铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后,对剩余固体成分的判断正确的是
A.肯定有银 B.肯定有铜 C.可能有铁 D.可能是铁和银.
考点:物质的相互转化和制备,铁的冶炼,金属锈蚀的条件及其防护,金属资源的保护,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:①根据铁生锈的原理进行分析;
②根据题中的叙述找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;
③根据铁锈的主要成分是氧化铁,氧化铁、铁都会与盐酸反应进行分析;
④根据铜、铁都会与硝酸银反应,在金属发生置换反应时,活动性强的金属先参与置换反应,活动性弱的金属再进行置换反应等知识进行分析.
②根据题中的叙述找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;
③根据铁锈的主要成分是氧化铁,氧化铁、铁都会与盐酸反应进行分析;
④根据铜、铁都会与硝酸银反应,在金属发生置换反应时,活动性强的金属先参与置换反应,活动性弱的金属再进行置换反应等知识进行分析.
解答:解:①铁生锈实质是铁与空气中的氧气、水共同作用的结果,所以铁生锈的条件是:铁和氧气、水充分接触;
②一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:Fe2O3+3CO
2Fe+3CO2;
③部分生锈的铁加入过量的稀盐酸,氧化铁和盐酸反应会生成氯化铁和水,铁和盐酸反应会生成氯化亚铁和氢气,所以黄色溶液中的溶质是:FeCl3、FeCl2;
④将铁粉和铜粉的混合物放入硝酸银溶液中,铁和铜都能置换出银,所以固体中一定含有银,故A正确,如果硝酸银足够多,铜也会与硝酸银发生置换反应,固体中就没有铜,故B错误,铁足够多的话,将银全部置换出来,铁有剩余,故C正确,铁足够多时,反应后铁有剩余,铜就不会发生置换反应,所以固体中也应该有铜,故D错误.故选:A、C.
故答案为:①铁和氧气、水充分接触;
②Fe2O3+3CO
2Fe+3CO2;
③FeCl3、FeCl2;
④A、C.
②一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:Fe2O3+3CO
| ||
③部分生锈的铁加入过量的稀盐酸,氧化铁和盐酸反应会生成氯化铁和水,铁和盐酸反应会生成氯化亚铁和氢气,所以黄色溶液中的溶质是:FeCl3、FeCl2;
④将铁粉和铜粉的混合物放入硝酸银溶液中,铁和铜都能置换出银,所以固体中一定含有银,故A正确,如果硝酸银足够多,铜也会与硝酸银发生置换反应,固体中就没有铜,故B错误,铁足够多的话,将银全部置换出来,铁有剩余,故C正确,铁足够多时,反应后铁有剩余,铜就不会发生置换反应,所以固体中也应该有铜,故D错误.故选:A、C.
故答案为:①铁和氧气、水充分接触;
②Fe2O3+3CO
| ||
③FeCl3、FeCl2;
④A、C.
点评:在解此类题时,首先分析题中的反应原理,然后结合学过的知识和题中所给的条件进行分析解答,注意金属活动性在置换反应中的应用.

练习册系列答案
相关题目
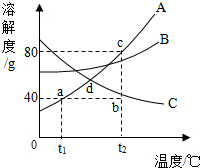 如图是常见固体物质A、B的溶解度曲线,下列说法不正确的是( )
如图是常见固体物质A、B的溶解度曲线,下列说法不正确的是( )| A、t1℃时,A物质的溶解度为40g |
| B、将140 g A物质的b点溶液变饱和,可以加入40 g A物质或将温度降至t1℃ |
| C、t2℃时A、B两种物质饱和溶液的溶质质量分数A>B |
| D、若将d点温度下A、B的饱和溶液降温至t1℃,析出的晶体A>B |
“神州七号”太空舱利用NiFe2O4将航天员呼出的废气转化为航天员需要的气体,而NiFe2O4的质量和化学性质都不变化,在该过程中NiFe2O4是( )
| A、反应物 | B、生成物 |
| C、催化剂 | D、消毒剂 |
单氟磷酸钠(Na2PO3F)是牙膏中常见的活性添加剂.若已知其中氟(F)元素的化合价为-1价,则单氟磷酸钠中磷元素的化合价为( )
| A、+5 | B、+3 | C、+2 | D、-3 |
 化学与生活息息相关,请用化学知识回答下列问题.
化学与生活息息相关,请用化学知识回答下列问题.