题目内容
学校化学兴趣小组对一包粗盐进行提纯,并用粗盐提纯后的氯化钠来配制一定质量分数的NaCl溶液.
(1)粗盐中含有MgCl2、CaCl2以及泥沙等杂质,为了有效将粗盐提纯,实验的各步操作流程如下图所示,请回答:
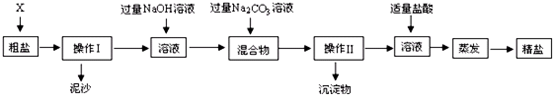
①在完成操作Ⅰ之前,必须加入的X物质是
②操作Ⅰ和操作Ⅱ的名称是
③在实验过程中加入过量的NaOH溶液,其实验目的是
④实验所得精盐的质量大于粗盐中NaCl的质量,原因是
(2)老师拿出实验后回收的氯化钠溶液,请同学们测定其溶质的质量分数.经过讨论,大家决定利用以下两种方法:
①蒸发结晶法:取一定量的氯化钠溶液,将其倒入蒸发皿中,加热蒸发,得到食盐晶体.多次测量计算所需的各个物理量后,数据如下表所示:
计算用该方法测得的氯化钠溶液的溶质质量分数.
②化学沉淀法:取20g 氯化钠溶液,倒入烧杯中,然后滴加溶质质量分数为17%的硝酸银溶液,反应完全时消耗硝酸银溶液的质量为34.2g.计算用该方法测得的氯化钠溶液的溶质质量分数.
(1)粗盐中含有MgCl2、CaCl2以及泥沙等杂质,为了有效将粗盐提纯,实验的各步操作流程如下图所示,请回答:

①在完成操作Ⅰ之前,必须加入的X物质是
水
水
.②操作Ⅰ和操作Ⅱ的名称是
过滤
过滤
.③在实验过程中加入过量的NaOH溶液,其实验目的是
除尽氯化镁
除尽氯化镁
,有关化学方程式是MgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
.④实验所得精盐的质量大于粗盐中NaCl的质量,原因是
在粗盐提纯的过程中有氯化钠生成
在粗盐提纯的过程中有氯化钠生成
.(2)老师拿出实验后回收的氯化钠溶液,请同学们测定其溶质的质量分数.经过讨论,大家决定利用以下两种方法:
①蒸发结晶法:取一定量的氯化钠溶液,将其倒入蒸发皿中,加热蒸发,得到食盐晶体.多次测量计算所需的各个物理量后,数据如下表所示:
| 蒸发皿的质量 | 蒸发皿的质量+ 食盐溶液的质量 |
蒸发皿的质量+ 食盐晶体的质量 |
| 28.8g | 48.8g | 30.7g |
②化学沉淀法:取20g 氯化钠溶液,倒入烧杯中,然后滴加溶质质量分数为17%的硝酸银溶液,反应完全时消耗硝酸银溶液的质量为34.2g.计算用该方法测得的氯化钠溶液的溶质质量分数.
分析:(1)提纯粗盐的步骤为溶解、过滤、蒸发;
加入氢氧化钠溶液时,能和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入碳酸钠溶液时,能和氯化钙反应生成碳酸钙沉淀和氯化钠,加入适量的稀盐酸时,能和过量的氢氧化钠反应生成氯化钠和水,能和过量的碳酸钠反应生成氯化钠、水和二氧化碳;
(2)根据提供的数据可以计算氯化钠的质量、氯化钠溶液的质量,进一步可以计算氯化钠溶液的质量分数.
加入氢氧化钠溶液时,能和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入碳酸钠溶液时,能和氯化钙反应生成碳酸钙沉淀和氯化钠,加入适量的稀盐酸时,能和过量的氢氧化钠反应生成氯化钠和水,能和过量的碳酸钠反应生成氯化钠、水和二氧化碳;
(2)根据提供的数据可以计算氯化钠的质量、氯化钠溶液的质量,进一步可以计算氯化钠溶液的质量分数.
解答:解:(1)①提纯粗盐时,首先要把粗盐溶解,所以X是水.
故填:水.
②操作Ⅰ和操作Ⅱ的名称是过滤.
故填:过滤.
③在实验过程中加入过量的NaOH溶液,其实验目的是除尽氯化镁,反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
故填:除尽氯化镁;MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
④实验所得精盐的质量大于粗盐中NaCl的质量,原因是在粗盐提纯的过程中有氯化钠生成.
故填:在粗盐提纯的过程中有氯化钠生成.
(2)①氯化钠的质量为:30.7g-28.8g=1.9g,氯化钠溶液的质量为:48.8g-28.8g=20g,
氯化钠溶液的质量分数为:
×100%=9.5%.
故填:9.5%.
②解:设氯化钠的质量为X,
NaCl+AgNO3 ═NaNO3 +AgCl↓,
58.5 170
X 34.2g×17%
=
,
X=2.0g,
氯化钠溶液的质量分数为:
×100%=10%.
故填:10%.
故填:水.
②操作Ⅰ和操作Ⅱ的名称是过滤.
故填:过滤.
③在实验过程中加入过量的NaOH溶液,其实验目的是除尽氯化镁,反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
故填:除尽氯化镁;MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
④实验所得精盐的质量大于粗盐中NaCl的质量,原因是在粗盐提纯的过程中有氯化钠生成.
故填:在粗盐提纯的过程中有氯化钠生成.
(2)①氯化钠的质量为:30.7g-28.8g=1.9g,氯化钠溶液的质量为:48.8g-28.8g=20g,
氯化钠溶液的质量分数为:
| 1.9g |
| 20g |
故填:9.5%.
②解:设氯化钠的质量为X,
NaCl+AgNO3 ═NaNO3 +AgCl↓,
58.5 170
X 34.2g×17%
| 58.5 |
| 170 |
| X |
| 34.2g×17% |
X=2.0g,
氯化钠溶液的质量分数为:
| 2.0g |
| 20g |
故填:10%.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.

练习册系列答案
相关题目
 13、学校化学兴趣小组进行探究性学习,同学们设计如右图所示装置进行一系列的实验;
13、学校化学兴趣小组进行探究性学习,同学们设计如右图所示装置进行一系列的实验; 某学校化学兴趣小组同学在学习了制取氧气这~节内容后,发现在实验室里用5%H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是
某学校化学兴趣小组同学在学习了制取氧气这~节内容后,发现在实验室里用5%H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是 某学校化学兴趣小组在化学实验室做实验时,甲班的王明同学把一种白色固体和一种无色液体混合,发现固体溶解时放出热量但没有气体放出.乙班的张正同学把两种无色液体混合时,也出现了同样的现象.
某学校化学兴趣小组在化学实验室做实验时,甲班的王明同学把一种白色固体和一种无色液体混合,发现固体溶解时放出热量但没有气体放出.乙班的张正同学把两种无色液体混合时,也出现了同样的现象.