题目内容
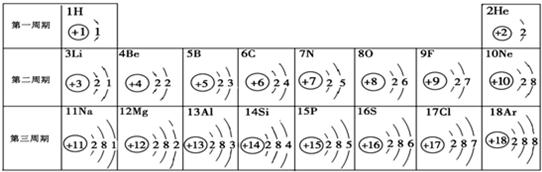
下面是元素周期表中1-18号元素原子的排列情况,根据此表我对它进行探究:
(1)从上表中我探究出以下规律:在原子里,核电荷数=原子序数=
(2)第11号元素属于
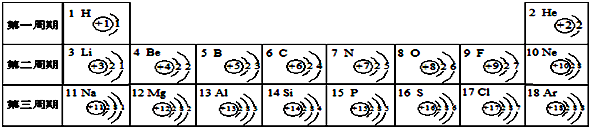
(3)某元素的原子结构示意图如图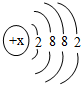 所示:则X=
所示:则X=

(1)从上表中我探究出以下规律:在原子里,核电荷数=原子序数=
质子数(或电子数)
质子数(或电子数)
.我通过细致地分析,还可以总结出一些规律:决定元素种类的是质子数
决定元素种类的是质子数
、原子核外电子层数=周期数
原子核外电子层数=周期数
.(2)第11号元素属于
金属
金属
元素(填“金属”或“非金属”),它的原子在化学反应中容易失
失
电子(填“得”或“失”),变成Na+
Na+
(填离子符号).(3)某元素的原子结构示意图如图
 所示:则X=
所示:则X=20
20
,它位于元素周期表中的第四
四
周期,该元素的化学性质与上表中的Mg或Be
Mg或Be
元素的化学性质相似.(填元素符号)分析:(1)根据原子序数表示的意义,利用表中的数字来分析规律;根据提供的周期表,从横行和竖行来分析元素周期表中的规律.
(2)根据原子序数来判断元素,利用原子结构来分析性质并书写离子的符号.
(3)原子中,质子数=核外电子数;决定元素化学性质的是原子的最外层电子数.
(2)根据原子序数来判断元素,利用原子结构来分析性质并书写离子的符号.
(3)原子中,质子数=核外电子数;决定元素化学性质的是原子的最外层电子数.
解答:解:(1)因原子中,质子数等于核电荷数等于核外电子数,由周期表中的数字观察可发现原子结构中的质子数与原子序数相同;根据周期表可以发现在同一周期的元素的原子结构中的电子层数都是相同的,如第二周期都是2个电子层,在同一竖行的最外层电子数都相同,如第一列,最外层电子数都是1,决定元素种类的是质子数;金属元素原子的最外层电子数一般少于4个;同一周期元素原子的最外层电子数依次递增;同一族元素原子的最外层电子数相等.
(2)因原子序数为11的元素是钠元素,名称的偏旁为“金”,则属于金属元素,因原子结构中最外层电子数为1,则在反应中容易失去1个电子而满足最外层8电子的稳定结构,钠原子变为钠离子,钠离子带1个单位的正电荷,其符号为Na+,
(3)该元素的原子x=2+8+8+2=20,原子中有四个电子层,所以它处在的四周期,元素的化学性质取决于最外层电子数,所以该元素与Mg、Be化学性质相似.
故答案为:(1)质子数(或电子数);决定元素种类的是质子数;原子核外电子层数=周期数;金属元素原子的最外层电子数一般少于4个;同一周期元素原子的最外层电子数依次递增;同一族元素原子的最外层电子数相等.(其它合理答案也可)
(2)金属;失;Na+(3)20;四;Mg.
(2)因原子序数为11的元素是钠元素,名称的偏旁为“金”,则属于金属元素,因原子结构中最外层电子数为1,则在反应中容易失去1个电子而满足最外层8电子的稳定结构,钠原子变为钠离子,钠离子带1个单位的正电荷,其符号为Na+,
(3)该元素的原子x=2+8+8+2=20,原子中有四个电子层,所以它处在的四周期,元素的化学性质取决于最外层电子数,所以该元素与Mg、Be化学性质相似.
故答案为:(1)质子数(或电子数);决定元素种类的是质子数;原子核外电子层数=周期数;金属元素原子的最外层电子数一般少于4个;同一周期元素原子的最外层电子数依次递增;同一族元素原子的最外层电子数相等.(其它合理答案也可)
(2)金属;失;Na+(3)20;四;Mg.
点评:本题难度不大,了解粒子结构示意图的意义,灵活运用元素周期表中元素的信息是正确解答本题的关键.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目