题目内容
【题目】废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属铜,实验流程如图所示(部分生成物已略去)。已知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
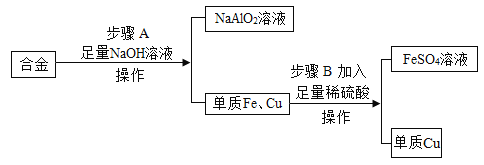
(1)单质铁的金属活动性比铜_______(填“强”或“弱”)。
(2)操作Ⅱ用到的玻璃仪器有烧杯、漏斗和_________(填仪器名称)。
(3)步骤B发生反应的化学方程式为_____________,该反应属于基本反应类型中的________反应。
(4)铝制品在空气中耐腐蚀的原因是________________。
【答案】强 玻璃棒 Fe+H2SO4=FeSO4+H2↑ 置换 在常温下,铝和空气中的氧气反应生成一层致密的氧化铝薄膜,阻止铝进一步被氧化
【解析】
本题需要了解金属的活动性顺序以及实验操作中对各种操作的了解。
(1)在金属活动性顺序中,铁的金属活动性比铜强。
(2)操作I、II用于分离固体和液体,其操作的名称为过滤,操作II用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(3)步骤B发生的反应是铁和稀硫酸反应生成硫酸亚铁和氢气,配平之后化学方程式为:![]() ,可知该反应属于基本反应类型中的置换反应。
,可知该反应属于基本反应类型中的置换反应。
(5)铝制品在空气中耐腐蚀的原因是在空气中铝制品更耐腐蚀的原因是铝在空气中会形成致密的保护膜,阻止铝制品进一步被氧化。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目