题目内容
【题目】大黄同学喝“养乐多”时感觉有酸味,他猜测其中有酸。査阅资料大黄同学得知,养乐多含有乳酸。
(提出问题)乳酸是否具有酸的通性?
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
在乳酸溶液中加入石蕊 | 石蕊变红 | 乳酸具有酸的通性 |
在乳酸溶液中加入_____(填化学式) | 有气泡产生,点燃气泡产生爆鸣声 | |
在乳酸溶液中加入碳酸氢钠 | _____ |
(实验反思)(1)从微粒角度看,乳酸具有酸的通性是因为其溶液中存在大量_____;
(2)乳酸化学符号用HL表示,写出乳酸和碳酸氢钠反应的化学方程式_____。
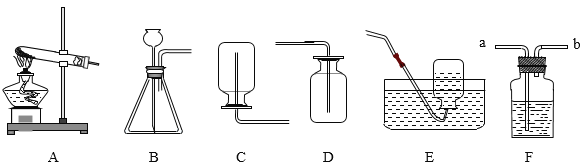
(定量研究)为测定乳酸组成元素和化学式,称取6.0g乳酸放入如图加热装置中(夹持仪器未画出),通入充足氧气使之完全燃烧,将反应后的混合气体先后通过装置B、C.试回答:

(1)为顺利完成实验,将方框内所示装置放入B、C位置时,正确的导管连接顺序是:_____→_____→_____→_____;
(2)按正确方式连接B、C装置进行实验,实验后测得氢氧化钠溶液增重_____g,浓硫酸增重3.6g,则乳酸中碳元素:氢元素质量比=6:1;
(3)已知乳酸相对分子质量是90,则乳酸的化学式为_____。
(反思拓展)乳酸经过聚合反应可以制成聚乳酸塑料[(C3H4O2)n,n>1000],聚乳酸塑料常温下会降解生成CO2和H2O.以下对聚乳酸认识正确的是_____。
A 聚乳酸制成的外卖快餐饭盒,不会产生“白色污染”
B 聚乳酸是一种有机高分子化合物
C 聚乳酸降解发生了分解反应
D聚乳酸中碳元素:氢元素:氧元素质量比=9:1:8
【答案】Fe 产生气泡,气体能使澄清石灰水变浑浊 氢离子 NaHCO3+HL═NaL+H2O+CO2↑ c d a b 8.8 C3H6O3 AB
【解析】
[实验探究]
在乳酸溶液中加入石蕊,溶液变红色,说明溶液显酸性;
在乳酸溶液中加入Fe,有气泡产生,点燃气泡产生爆鸣声,是因为乳酸和铁反应生成乳酸亚铁和氢气,氢气不纯燃烧由爆鸣声;
在乳酸溶液中加入碳酸氢钠,产生气泡,气体能使澄清石灰水变浑浊,是因为乳酸和碳酸氢钠反应生成乳酸钠、水和二氧化碳,实验过程如下所示:
实验步骤 | 实验现象 | 实验结论 |
在乳酸溶液中加入石蕊 | 石蕊变红 | 乳酸具有酸的通性 |
在乳酸溶液中加入Fe | 有气泡产生,点燃气泡产生爆鸣声 | |
在乳酸溶液中加入碳酸氢钠 | 产生气泡,气体能使澄清石灰水变浑浊 |
[实验反思]
(1)从微粒角度看,乳酸具有酸的通性是因为其溶液中存在大量氢离子。故填:氢离子。
(2)乳酸和碳酸氢钠反应的化学方程式:NaHCO3+HL═NaL+H2O+CO2↑。故填:NaHCO3+HL═NaL+H2O+CO2↑。
[定量研究]
(1)该实验通过测量生成水的质量确定原物质中氢元素的质量,通过测定生成二氧化碳的质量确定原物质中碳元素的质量,由于氢氧化钠溶液中有水,故要先测定生成水的质量,后测定生成二氧化碳的质量,并且将生成的气体与吸收气体的浓硫酸和氢氧化钠溶液充分接触,使生成的水和二氧化碳完全吸收,故气体由长管c、a通入,故为顺利完成实验,将方框内所示装置放入B.C位置时,正确的导管连接顺序是:c→d→a→b。
故填:c;d;a;b。
(2)浓硫酸增重3.6g,说明反应生成3.6g水,其中含有氢元素质量为:3.6g×![]() =0.4g,
=0.4g,
乳酸中碳元素:氢元素质量比=6:1,则碳元素质量为:0.4g×6=2.4g,
反应生成二氧化碳质量为:2.4g÷![]() =8.8g,
=8.8g,
实验后测得氢氧化钠溶液增重8.8g。故填:8.8。
(3)乳酸中氧元素质量为:6.0g﹣0.4g﹣2.4g=3.2g,
乳酸中碳原子、氢原子、氧原子个数比为:![]() =1:2:1,设每个乳酸分子中碳原子个数为x,则12x+2x+16x=90,x=3,则氢原子是6个,氧原子是3个,乳酸的化学式为 C3H6O3。故填:C3H6O3。
=1:2:1,设每个乳酸分子中碳原子个数为x,则12x+2x+16x=90,x=3,则氢原子是6个,氧原子是3个,乳酸的化学式为 C3H6O3。故填:C3H6O3。
[反思拓展]
A.聚乳酸制成的外卖快餐饭盒,不会产生“白色污染”,这是因为聚乳酸塑料常温下会降解生成CO2和H2O,该选项说法正确;
B.聚乳酸是一种有机高分子化合物,该选项说法正确;
C.聚乳酸降解时,和氧气反应生成水和二氧化碳,不是分解反应,该选项说法不正确;
D.聚乳酸中碳元素、氢元素、氧元素质量比为:(12×3):(1×6):(16×3)=6:1:8,该选项说法不正确。故填:AB。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案