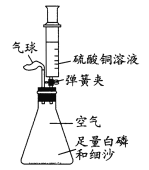
题目内容
【题目】请根据要求填空:
(1)用棉花分别蘸酒精和水,放到酒精灯火焰上加热片刻,通过此实验,可以说明燃烧的条件之一是__。
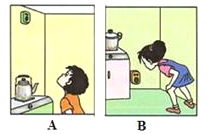
(2)在家中使用天然气时,为安全起见,应在厨房安装天然气泄漏报警器,报警器安装的正确位置应选择图中的________。
(3)下列混合气体遇明火,可能发生爆炸的是________。
A.一氧化碳和空气 B.氢气和一氧化碳 C.二氧化碳和氧气 D.甲烷和氧气
(4)符号3SO42-中数字“2”的意义是________。
(5)科学家采用新技术,将二氧化碳和氢气以一定比例混合,在一定条件下发生了如下反应:2CO2+
6H2+4H2O+X,则X的化学式为_____。
(6)KClO3中________(填“含有”或“不含有”)氧分子,它________(填“属于”或“不属于”)氧化物。
(7)图2表示治理汽车尾气所涉及反应的微观过程。
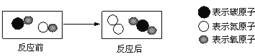
该反应中,生成的单质与化合物的分子个数比为________ 质量比为________.
(8)长期存放石灰水的试剂瓶壁上常常有一层白色固体,形成该白色固体的原因是(用化学方程式表示)________,若要将该试剂瓶清洗干净,可选用下列物质中的________(填序号)
A.自来水 B.热水 C.稀盐酸 D.白猫清洗精
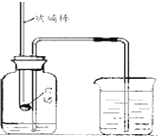
(9)有一种无色气体,可能是氢气.一氧化碳.二氧化碳中的一种或几种混合组成,用此气体做以下实验①将此气体通入澄清石灰水,无浑浊现象,②将此气体经尖嘴导管导出后点燃,气体燃烧,在火焰上方罩一个干冷的烧杯,烧杯内壁有水珠出现.根据以上实验现象推断:此气体中一定含有________(写化学式,下同),可能含有________。
(10)某瓶气体中碳、氧两种元素的质量比是1:2,则该气体可能是________.
A.CO B.CO2和O2的混合物 C.CO2 D.CO和O2混合物 E.CO和CO2的混合物
【答案】可燃物AAD每个硫酸根离子带两个单位的负电荷C2H4不含有不属于1:27:22CO2+Ca(OH)2=CaCO3↓+H2O C H2CODE
【解析】
(1)用棉花分别蘸取酒精和水,放在酒精灯火焰上加热片刻,观察到的现象为酒精燃烧,水没有燃烧,通过此实验,可以说明燃烧的条件之一是要可燃物;上述实验中,如果在酒精灯上加热时间较长两个棉球都会燃烧起来,原因是蘸有酒精的棉花球因酒精燃烧放出的热量传给棉花球,使温度达到棉花的着火点,引起棉花燃烧;蘸有水的棉花球当水分蒸发完后,棉花球暴露在酒精灯的火焰中使温度上升达到棉花着火点,且棉花球与空气接触,也达到燃烧所需的三个条件,引起棉花燃烧;
(2)因为天然气的密度比空气小,在家中使用天然气时,天然气泄漏报警器应该安装在上方;
(3)A、一氧化碳属于可燃物,氧气能够支持一氧化碳燃烧,一氧化碳和氧气混合,遇明火可能发生爆炸;B、氢气属于可燃物,一氧化碳属于可燃物,没有助燃剂,氢气和一氧化碳混合,遇明火不可能发生爆炸;C、氧气、二氧化碳都不是可燃物,氧气和二氧化碳混合,遇明火不可能发生爆炸;D、甲烷属于可燃物,氧气能够支持甲烷燃烧,甲烷和氧气混合,遇明火可能发生爆炸。故本题选AD;
(4)符号3SO42-中数字“2”的意义是每个硫酸根离子带两个单位的负电荷;
(5)由质量守恒定律可知:反应前后,原子种类、数目均不变,由反应的化学方程式2CO2+6H2═4H2O+X,反应前碳、氢、氧原子个数分别为2、12、4,反应后的生成物中碳、氢、氧原子个数分别为0、8、4,根据反应前后原子种类、数目不变,则每个X分子由2个碳原子和4个氢原子构成,则物质X的化学式为C2H4;
(6)KClO3中含有氧元素,不含氧分子,KClO3由三种元素组成,不属于氧化物;
(7)反应后生成生成2个CO2分子和1个N2分子,因此反应中生成的单质和化合物的物质的量之比为1:2;根据反应的化学方程式为:2CO+2NO═N2+2CO2,生成单质与化合物的质量比=28:(44×2)=7:22;
(8)石灰水中的溶质是氢氧化钙,能与空气中的二氧化碳反应生成碳酸钙白色沉淀和水,该沉淀的主要成分是CaCO3,反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;碳酸钙难溶于水,能与酸反应,实验室洗涤该试剂瓶可用稀盐酸洗去。故本题选C。
(9)混合气体通入澄清的石灰水中,无浑浊现象出现,说明气体中不含二氧化碳;将此气体经尖嘴导管导出后点燃,气体燃烧,在火焰上方罩一个干冷的烧杯,烧杯内壁有水珠出现,说明一定含有氢气,化学式为H2,可能含有一氧化碳,化学式为CO;
(10)根据混合气体中含有C、O元素,假设气体全为CO,则CO中C、O元素的质量比为12:16=3:4;假设气体全为CO2,则CO2中C、O元素的质量比为12:16×2=3:8,由混合气体中碳、氧两种元素的质量比为1:2,因3:8<1:2<3:4,又因氧气中不含碳元素,氧气的存在只能够使C与O元素的质量比的数值变小,则要满足混合气体中碳、氧两种元素的质量比为1:2,混合气体中必须含有CO,故本题选DE。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案