题目内容
【题目】多角度认识物质能帮助我们更全面地了解物质世界。以金属为例回答下列问题:
(1)认识金属元素的存在
①在自然界中,大多数金属以化合物存在,而金、铂等极少数金属因为化学性质_____(填“活泼”或“不活泼”)却能以单质存在。
②常见铁矿石有:黄铁矿(主要成分 FeS2)、磁铁矿(主要成分 Fe3O4)等。这两种铁矿石的主要成分含铁元素质量分数较大的是_____。
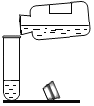
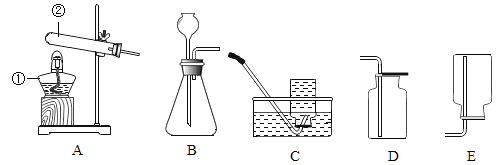
(2)认识金属的性质 用粗木棍在涂有蜡的锌板上写“南”、平”两个字,露出下面的锌板。向“南”字上滴加稀盐酸,向“平”字上滴加 CuSO4 溶液。
①“南”字上的现象是_____。
②“平”字上有红色物质析出,用化学方程式解释:_____。
(3)认识金属的制备,工业上,金属钨(W)可由氢气和三氧化钨(WO3)在高温下发生置换反应制得。 反应中化合价升高的元素是_____。
(4)认识金属的用途烤制食物时常用到铝箔,主要利用了金属铝的_____ (填性质)。

【答案】不活泼 Fe3O4 冒气泡 Zn+CuSO4=Cu+ZnSO4 氢元素 导热性和延展性
【解析】
(1)①在自然界中,极少数化学性质不活泼的金属如金、铂等以单质存在;
②由于一个硫原子的质量相当于两个氧原子的质量,故FeS2中铁原子和硫原子的个数比相当于为:Fe:O═1:4,Fe3O4中铁原子和氧原子的个数比为:Fe:O═3:4,故铁元素的质量分数高的是Fe3O4;
(2)①锌与稀盐酸反应产生氢气,故产生气泡;②“平”锌与硫酸铜反应生成红色铜和硫酸锌;用化学方程式解释:Zn+CuSO4=Cu+ZnSO4。
(3)三氧化钨与氢气在高温的条件下反应生成金属钨和水,故反应方程式为:WO3+3H2 ![]() 3H2O+W,该反应前后氢元素的化合价由0变为+1,升高了;
3H2O+W,该反应前后氢元素的化合价由0变为+1,升高了;
(4)烤制食物、金属铝能压成铝箔,说明金属铝具有优良的导热性和延展性。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】二氧化锰在分解过氧化氢溶液反应中的催化原理为:![]() ;
;![]() 。取不同制备方法的二氧化锰与5 mL 10%过氧化氢溶液反应,测得实验数据如下表:
。取不同制备方法的二氧化锰与5 mL 10%过氧化氢溶液反应,测得实验数据如下表:
二氧化锰制备方法 | 高温分解法 | 电解法(市售) | 水热法 |
比表面积/ m2﹒g-1 | 0.468 | 49.3 | 223.274 |
催化剂的质量/mg | 3 | 3 | a |
平均催化速率/mL﹒s-1 | 0.1 | 0.4 | 0.6 |
30 s内产生氧气的体积/mL | 3 | 12 | b |
(1)根据催化原理,你对催化剂的一种新的认识是_____。
(2)根据上表数据分析:a=_____;b=_____。若使催化剂的催化速率最大,要尽可能增大_____。