题目内容
【题目】向盐酸与氯化钙的混合溶液中逐滴滴入质量分数10%的碳酸钠溶液至过量。记录pH变化关系如图所示。下列说法正确的是

A. ab段反应有白色沉淀生成
B. b点所得溶液中溶质为NaCl和CaCl2
C. bc段溶液质量增加106g
D. b、c、d点溶液中NaCl质量关系:m(d)=m(c)=2m(b)
【答案】BD
【解析】
向盐酸与氯化钙的混合溶液中逐滴滴入质量分数10%的碳酸钠溶液至过量,碳酸钠先与盐酸反应,溶液的pH值增大,然后再与氯化钙反应,溶液的pH值不变,反应结束,加入的碳酸钠过量,溶液的pH值增大。
根据以上分析可知:
A、ab段的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,有气体生成,没有沉淀生成。故A错误;
B、b点所得溶液pH值等于7,盐酸恰好完全反应,所以溶液中的溶质为NaCl和CaCl2,故B正确;
C、bc段的反应是碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,消耗的碳酸钠溶液的质量=212g-106g=106g。设:与106g碳酸钠溶液反应生成碳酸钙的质量为x。

![]() x=10g
x=10g
溶液质量增加106g﹣10g=96g,故C错误;
D、依据钠元素守恒可知,b点溶液中的氯化钠质量为: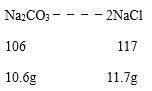 ;
;
c点溶液中的氯化钠质量为: ;cd段不会生成氯化钠,所以b、c、d点溶液中NaCl质量关系:m(d)=m(c)=2m(b),故D正确。故选BD。
;cd段不会生成氯化钠,所以b、c、d点溶液中NaCl质量关系:m(d)=m(c)=2m(b),故D正确。故选BD。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目