题目内容
【题目】某工厂排放的废水中含有硫酸铜,将废水处理可得到铜和氧化铁两种产品。过程如下图所示:
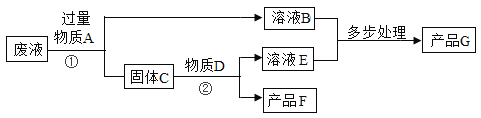
(1)过程①中发生反应的化学反应方程式为____________。
(2)过程②中发生反应的化学反应方程式为_____________。
(3)加入过量A的作用是_________。
(4)产品F和G分别是__________。
【答案】Fe+CuSO4=FeSO4+Cu Fe + H2SO4 = FeSO4 + H2↑ 除去剩余的铁 铜(Cu)、氧化铁(Fe2O3)
【解析】
由于题目中指出:“处理可得到铜和氧化铁两种产品”,根据质量守恒定律可知,要想制取铜,需将硫酸铜中的铜置换出,铁和硫酸铜溶液反应,生成硫酸亚铁和铜,符合题意的物质A金属为铁,由于要将全部铜离子置换出来,需要加入过量的A(铁);由于加入是过量铁,由铁有剩余,故固体C的成分为剩余的铁和生成的铜;要获得产品铜,就要除去剩余的铁,在金属活动顺序表中,铁位于氢之前,而铜位于氢之后,铁可和稀硫酸反应,而铜不反应,故可在固体C中加入适量的稀硫酸,由此确定产品F为铜,溶液B和溶液E均为硫酸亚铁溶液,另一种产品G则只能是氧化铁。
(1)过程①中物质A是过量的铁,加入A发生的化学方程式为:Fe+CuSO4=FeSO4+Cu;
(2)过程②中物质D是适量的硫酸,发生反应是铁与硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe + H2SO4 = FeSO4 + H2↑;
(3)加入过量A的作用是除去剩余的铁;
(4)产品F和G分别是铜(Cu)、氧化铁(Fe2O3)。

【题目】某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2)。该小组同学对该气体的成分进行如下探究:

(猜想与假设)小华说:该气体可能是CO2、O2、CO、H2、N2。
(1)小明说:不可能含有N2,因为_____。
(2)小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO_____。该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
(进行实验)
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(得出结论)(3)由实验①可知,该气体中肯定含有_____,写出该反应的化学方程式_____。
(4)由实验②_____(填“能”或“不能”)确定该气体中不含氧气,理由是_____。
【题目】草木灰是农村常用的一种肥料(其有效成分是K2CO3外)。某兴趣小组为了测定草木灰中K2CO3外的含量,取现有的草木灰40g放入锥形瓶中,将40g盐酸分4次(每次10g)加入瓶中,所得溶液总质量与加入盐酸的关系如下表;已知K2CO3+2HCl=2KCl+H2O+CO2↑(假设草木灰中除K2CO3外,其它物质均不溶于水,也不与盐酸反应)
所加次数 | 第一次 | 第二次 | 第三次 | 第四次 |
锥形瓶中物质总质量/g | 49.68 | 59.36 | 69.12 | 79.12 |
(1)以上四次实验,其中盐酸有剩余的是_____。
(2)第一次加入盐酸后产生气体的质量为_____克。
(3)草木灰中K2CO3的质量分数为多少_____?