题目内容
将氯化钠和硫酸钠的混合物7.99g溶于22g水中,再向其中加入31.2g质量分数为20%的氯化钡溶液,恰好完全反应,过滤.求所得滤液中溶质的质量分数.(计算结果精确到0.1%)
分析:向硫酸钠和氯化钠组成的混合溶液中加入氯化钡溶液,硫酸钠与氯化钡发生反应生成硫酸钡沉淀和氯化钠,而混合溶液中的氯化钠不与氯化钡反应;至恰好完全反应后,所得溶液为氯化钠溶液,其溶质氯化钠由两部分组成:一部分为原混合物质中的氯化钠,另一部分则是反应生成的氯化钠;
综上所述,原混合物中的硫酸钠的质量,根据反应的化学方程式,可由生成氯化钡的质量而求得;所得溶液中溶质质量分数,则是原混合物中氯化钠与生成氯化钠质量总和与所得溶液的质量比.
综上所述,原混合物中的硫酸钠的质量,根据反应的化学方程式,可由生成氯化钡的质量而求得;所得溶液中溶质质量分数,则是原混合物中氯化钠与生成氯化钠质量总和与所得溶液的质量比.
解答:解:设混合物中Na2SO4的质量为x,生成NaCl的质量为y.BaCl2的质量=31.2g×20%=6.24g
Na2SO4+BaCl2═2NaCl+BaSO4↓
142 208 117 233
x 6.24g y z
=
=
=
x=4.26g y=3.51g z=6.99g
滤液中溶质NaCl的质量=7.99g-4.26g+3.51g=7.24g
滤液的质量=7.99g+22g+31.2g-6.99g=54.2g
滤液中NaCl的质量分数=
×100%=13.4%
答:所得滤液中溶质的质量分数为13.4%.
Na2SO4+BaCl2═2NaCl+BaSO4↓
142 208 117 233
x 6.24g y z
| 142 |
| x |
| 208 |
| 6.24g |
| 117 |
| y |
| 233 |
| z |
x=4.26g y=3.51g z=6.99g
滤液中溶质NaCl的质量=7.99g-4.26g+3.51g=7.24g
滤液的质量=7.99g+22g+31.2g-6.99g=54.2g
滤液中NaCl的质量分数=
| 7.24g |
| 54.2g |
答:所得滤液中溶质的质量分数为13.4%.
点评:利用质量守恒定律,可以很方便地解决反应后所得溶液的问题:反应后溶液质量=固体混合物质量+溶解所加水的质量+加入氯化钡溶液的质量-生成的沉淀质量.

练习册系列答案
相关题目
为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如下:
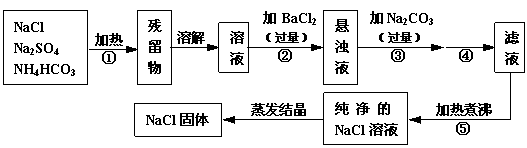 |
试回答下列问题:
(1)操作①的目的是 。操作②能否用硝酸钡溶液? (填“能”或“否”)。
(2)进行操作②后,如何判断SO 已除尽,方法是 。
已除尽,方法是 。
(3)写出操作③有关的化学反应方程式 。操作④的名称是 。
(4)此设计方案是否严密,说明理由  。
。
(5)原固体样品中含NaCl m1 g ,最后得到的NaCl固体m2 g ,则m1 m2(填“﹥”、“﹤”或“﹦”)