题目内容
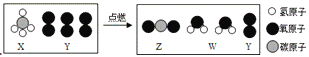
【题目】取四朵用石蕊溶液染成紫色的干燥的纸花,分别按如图进行实验.请根据图示进行思考并回答下表中的问题:
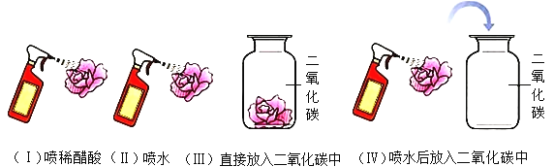
现象 | 紫色纸花变红 | 紫色纸花不变色 | 紫色纸花不变色 | _____ |
分析 | ①实验(Ⅲ)验证了_____: 实验(Ⅳ)验证了_____; ②通过实验(Ⅰ)、(Ⅳ),可验证酸的一条化学性质是_____: ③实验(Ⅳ)结束后,将纸花用酒精灯小心加热烘烤后纸花又变紫,说明碳酸_____,反应的化学方程式_____. | |||
【答案】紫色纸花变红色; 二氧化碳不能使紫色石蕊变红; 酸能使紫色石蕊溶液变红; 不稳定, 受热易分解, H2CO3=CO2↑+H2O.
【解析】
(1)由于二氧化碳与水反应生成了碳酸,碳酸能使紫色石蕊试液变红.所以观察到的现象是紫色纸花变红色;
①由紫色纸花不变色可知,验证了二氧化碳不能使紫色石蕊变红,故填二氧化碳不能使紫色石蕊变红;
由紫色纸花变红色验证了水和二氧化碳共同作用生成碳酸使紫色石蕊变红。
②由醋酸是一种酸,能使紫色的石蕊试液变红色,碳酸是一种酸,能使紫色的石蕊试液变红色,得出:酸能使紫色石蕊溶液变红,故填酸能使紫色石蕊溶液变红。
③将纸花用酒精灯小心加热烘烤后纸花又变紫,说明碳酸不稳定,受热易分解,故填不稳定,受热易分解;
碳酸受热后反应生成水和二氧化碳,故反应的反应的方程式写为:H2CO3=CO2↑+H2O。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案【题目】将一定量的丙醇(CH308)和氧气置于一个封闭的容器中引燃,其反应的化学方程式为: a C3 H8O+ b O2点燃 cCO2+dH2O+eX,测得反应前后各物质的质量如下表:
物 质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 8.8 | x |
下列判断正确的是
A. 表中x的值为2.8
B. X可能是该反应的催化剂
C. X可能为甲烷
D. 方程式中a:b=1:3
【题目】有A.B两种酸碱指示剂,它们显示的颜色与溶液明的关系如图1.它们在甲溶液和乙溶液中显示的颜色如图2.下列判断错误的是 ( )
溶液 指示剂 | 甲 | 乙 |
A | 黄色 | 蓝色 |
B | 无色 | 粉红色 |
图1
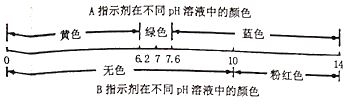
图2
A. 甲溶液呈酸性
B. 乙溶液的pH可能为11
C. 只用A指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体
D. 在滴有指示剂的甲溶液中不断地加入乙溶液。最后溶液一定呈绿色
【题目】某化学兴趣小组同学,用盐酸和氢氧化钠进行“酸碱中和反应”的探究,进行一段时间后发现没有明显变化,询问老师才知道忘记滴加指示剂。因此,他们停止实验,并在老师的指导下对烧杯内的溶液中的溶质的成分进行探究。
(提出问题)该烧杯内的溶质是什么?
(猜想假设)猜想一:NaCl 猜想二:NaCl和HCl
猜想三:NaCl和NaOH 猜想四:NaCl、NaOH和HCl
同学们讨论后一致认为猜想四不合理,请你说出不合理的理由______________________(用化学方程式表示)。
(查阅资料)NaCl溶液呈中性。
(实验探究)兴趣小组甲、乙、丙三位同学分别设计了如下的实验方案,请你帮助他们完成实验报告的相关内容。
实验方案 | 实验现象 | 实验结论 |
甲同学取少量烧杯内的溶液于试管中,滴入酚酞试液 | 溶液无变化 | 猜想一成立 |
乙同学另取少量烧杯内的溶液于试管中,加入_______。 | 有气泡生成 | 猜想二成立 |
丙同学另取少量烧杯内的溶液于试管中,滴加适量的CuSO4溶液 | 没有蓝色沉淀产生 | 猜想____不成立 |
(评价反思)老师看了甲、乙、丙三位同学的实验报告,指出甲同学的实验结论不准确,请你分析甲同学实验结论不准确的原因:___________。
(得出结论)猜想二成立
(拓展延伸)某同学在进行酸碱中和滴定实验时,测得溶液的pH变化如下图1所示,请回答下列问题:

(1)由图1可知,该同学实验操作是________________。
A.将盐酸滴入氢氧化钠溶液中
B.将氢氧化钠溶液滴入盐酸中
(2)由图1可知,在b点处溶液中溶质是______________________。
(3)图2为盐酸和氢氧化钠溶液反应的微观过程,从微粒的角度分析,此反应的微观实质_______________(合理答案即可)。